Электроны, заполняющие данный энергетический уровень, стремятся занять максимальное количество орбиталей, располагаясь на каждой по одному, чтобы суммарный спин был максимален. Например, 3d5:
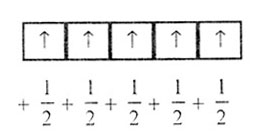
Задачи:
1. Каковы значения квантовых чисел n, l и m для орбиталей, входящих в 3d-подоболочку (подуровень)?
Ответ. Цифра, указанная в обозначении подуровня, является главным квантовым числом. Следовательно, n = 3. Буква в этом обозначении соответствует значению квантового числа l, s-орбитали имеют l = О, р-орбитали l = 1, а d-орбитали l = 2. Следовательно, для 3d-подуровня l = 2. Квантовое число может принимать все целочисленные значения от —1 до +1. Следовательно, может быть равно -2, -1, О, 1, 2. Таким образом, возможно существование всего пяти Зd-opбитaлeй.
2. Определите количество орбиталей, для которых n = 4, укажите значения чисел n, 1, m для каждой из этих орбиталей.
Ответ. Для n = 4 возможные значения чисел l таковы: 0, 1, 2 и 3. Это соответствует 4s-, 4p-, 4d- и 4f-подуровням. В них существует одна 4s-opбиталь (n = 4, l = 0, m1 = 0), три 4р-орбитали (n = 4, 1 = 1, m1 = —1, О, 1), пять 4d-орбиталей (n = 4, l = 3, m1 = —3, —2, — 1, О, 1, 2, 3).