ÌÎÑÊÎÂÑÊÈÉ ÝÍÅÐÃÅÒÈ×ÅÑÊÈÉ ÈÍÑÒÈÒÓÒ
(òåõíè÷åñêèé óíèâåðñèòåò)
ÔÀÊÓËÜÒÅÒ ÝËÅÊÒÐÎÍ
Н
ÎÉ ÒÅÕÍÈÊÈ
ÐÅÔÅÐÀÒ ÏÎ ÒÅÌÅ
Ê
ÈÍÅÒÈ×ÅÑÊÎÅ ÓÐÀÂÍÅÍÈÅ
Á
ÎËÜÖÌÀÍÀ.
ÂÛÏÎËÍÈË:
Êîðêèí Ñ.Â.
ÃÐÓÏÏÀ:
ЭТ-9-00
ÏÐÅÏÎÄÀÂÀÒÅËÜ
Øåðêóíîâ Þ.Á.
Âòîðàÿ ïîëîâèíà ðàáîòû íàáèòà äîñòàòî÷íî ñëîæíîé ìàòåìàòèêîé
. Àâòîð (
KorkinSV@mpei.ru
, korkin_s_v@chat.ru)íå ñ÷èòàåò ýòîò êóðñîâîé èäåàëüíûì, îí ìîæåò ñëóæèòü ëèøü îòïðàâíîé òî÷êîé äëÿ íàïèñàíèÿ áîëåå ñîâåðøåííîé (è ïîíÿòíîé) ðàáîòû. Òåêñò íå ÿâëÿåòñÿ êîïèåé êíèãè. Âñïîìîãàòåëüíóþ ëèòåðàòóðó ñì. â êîíöå.
Êóðñîâîé ïðèíÿò ñ îòìåòêîé ÎÒË. (Îêîí÷àòåëüíûé âàðèàíò ðàáîòû íåìíîæêî çàòåðÿëñÿ. Ïðåäëàãàþ âîñïîëüçîâàòüñÿ ïðåäïîñëåäíåé “âåðñèåé”).
2002 ãîä.
Ñîäåðæàíèå:
Ââåäåíèå……………………………………………………………………………… 3
Óñëîâíûå îáîçíà÷åíèÿ………………………………………………………………. 4
§
1 Ôóíêöèÿ ðàñïðåäåëåíèÿ.
§
2 Ñòîëêíîâåíèå ÷àñòèö.
§
3 Îïðåäåëåíèå âèäà èíòåãðàëà ñòîëêíîâåíèé
è óðàâíåíèÿ Áîëüöìàíà.
§
4. Êèíåòè÷åñêîå óðàâíåíèå äëÿ ñëàáî íåîäíîðîäíîãî ãàçà.
Òåïëîïðîâîäíîñòü ãàçà.
Некоторые условные обозначения:
n - концентрация частиц;
d - среднее расстояние между частицами;
V - некоторый объём системы;
P - вероятность некоторого события;
f - функция распределения;
Ââåäåíèå.
Ðàçäåëû ôèçèêè òåðìîäèíàìèêà, ñòàòèñòè÷åñêàÿ ôèçèêà è ôèçè÷åñêàÿ êèíåòèêà çàíèìàþòñÿ èçó÷åíèåì ôèçè÷åñêèõ ïðîöåññîâ, ïðîèñõîäÿùèõ â ìàêðîñêîïè÷åñêèõ ñèñòåìàõ - òåëàõ, ñîñòîÿùèõ èç áîëüøîãî ÷èñëà ìèêðî÷àñòèö.  çàâèñèìîñòè îò âèäà ñèñòåìû òàêèìè ìèêðî÷àñòèöàìè ìîãóò ÿâëÿòüñÿ àòîìû, ìîëåêóëû, èîíû, ýëåêòðîíû, ôîòîíû èëè èíûå ÷àñòèöû. Íà ñåãîäíÿøíèé äåíü ñóùåñòâóþò äâà îñíîâíûõ ìåòîäà èññëåäîâàíèÿ ñîñòîÿíèé ìàêðîñêîïè÷åñêèõ ñèñòåì - òåðìîäèíàìè÷åñêèé, õàðàêòåðèçóþùèé ñîñòîÿíèå ñèñòåìû ÷åðåç ìàêðîñêîïè÷åñêèå ëåãêî èçìåðÿåìûå ïàðàìåòðû (íàïðèìåð, äàâëåíèå, îáú¸ì, òåìïåðàòóðà
, количество молей или концентрация вещества
) è, ïî ñóòè, íå ó÷èòûâàþùèé àòîìíî-ìîëåêóëÿðíóþ ñòðóêòóðó âåùåñòâà, è ñòàòèñòè÷åñêèé ìåòîä, îñíîâàííûé íà àòîìíî-ìîëåêóëÿðíîé ìîäåëè ðàññìàòðèâàåìîé ñèñòåìû. Òåðìîäèíàìè÷åñêèé ìåòîä íå áóäåò çàòðàãèâàòüñÿ â äàííîé ðàáîòå. Ïî èçâåñòíûì çàêîíàì ïîâåäåíèÿ ÷àñòèö ñèñòåìû ñòàòèñòè÷åñêèé ìåòîä ïîçâîëÿåò óñòàíîâèòü çàêîíû ïîâåäåíèÿ âñåé ìàêðîñèñòåìû â öåëîì. Ñ öåëüþ óïðîùåíèÿ ðåøàåìîé çàäà÷è ïðè ñòàòèñòè÷åñêîì ïîäõîäå äåëàåòñÿ ðÿä ïðåäïîëîæåíèé (äîïóùåíèé) î ïîâåäåíèè ìèêðî÷àñòèö è, ñëåäîâàòåëüíî, ðåçóëüòàòû, ïîëó÷åííûå ñòàòìåòîäîì, ñïðàâåäëèâû ëèøü â ïðåäåëàõ ñäåëàííûõ äîïóùåíèé. Ñòàòèñòè÷åñêèé ìåòîä èñïîëüçóåò âåðîÿòíîñòíûé ïîäõîä ê ðåøåíèþ çàäà÷, äëÿ èñïîëüçîâàíèÿ ýòîãî ìåòîäà ñèñòåìà îáÿçàíà ñîäåðæàòü äîñòàòî÷íî áîëüøîå êîëè÷åñòâî ÷àñòèö. Îäíà èç çàäà÷, ðåøàåìàÿ ñòàòìåòîäîì, - âûâîä óðàâíåíèÿ ñîñòîÿíèÿ ìàêðîñêîïè÷åñêîé ñèñòåìû. Ñîñòîÿíèå ñèñòåìû ìîæåò áûòü íåèçìåííûì âî âðåìåíè (ðàâíîâåñíàÿ ñèñòåìà) ëèáî ìîæåò èçìåíÿòüñÿ ñ òå÷åíèåì âðåìåíè (íåðàâíîâåñíàÿ ñèñòåìà). Èçó÷åíèåì íåðàâíîâåñíûõ ñîñòîÿíèé ñèñòåì è ïðîöåññîâ, ïðîèñõîäÿùèõ â òàêèõ ñèñòåìàõ, çàíèìàåòñÿ ôèçè÷åñêàÿ êèíåòèêà.
Óðàâíåíèå ñîñòîÿíèÿ ðàçâèâàþùåéñÿ âî âðåìåíè ñèñòåìû ïðåäñòàâëÿåò ñîáîé êèíåòè÷åñêîå óðàâíåíèå, ðåøåíèå êîòîðîãî îïðåäåëÿåò ñîñòîÿíèå ñèñòåìû â ëþáîé ìîìåíò âðåìåíè. Èíòåðåñ ê êèíåòè÷åñêèì óðàâíåíèÿì ñâÿçàí ñ âîçìîæíîñòüþ èõ ïðèìåíåíèÿ â ðàçëè÷íûõ îáëàñòÿõ ôèçèêè: â êèíåòè÷åñêîé òåîðèè ãàçà, â àñòðîôèçèêå, ôèçèêå ïëàçìû, ìåõàíèêå æèäêîñòåé.
В данной работе рассматривается кинетическое уравнение, выведенное одним из основоположников статистической физики и физической кинетики австрийским физиком Людвигом Больцманом в 1872 году и носящее его имя.
§
1 Функция распределения.
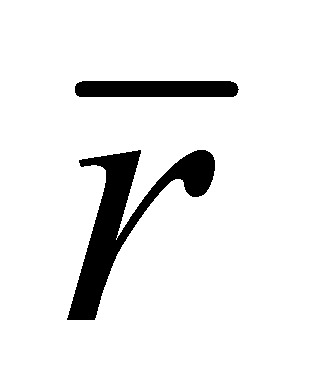
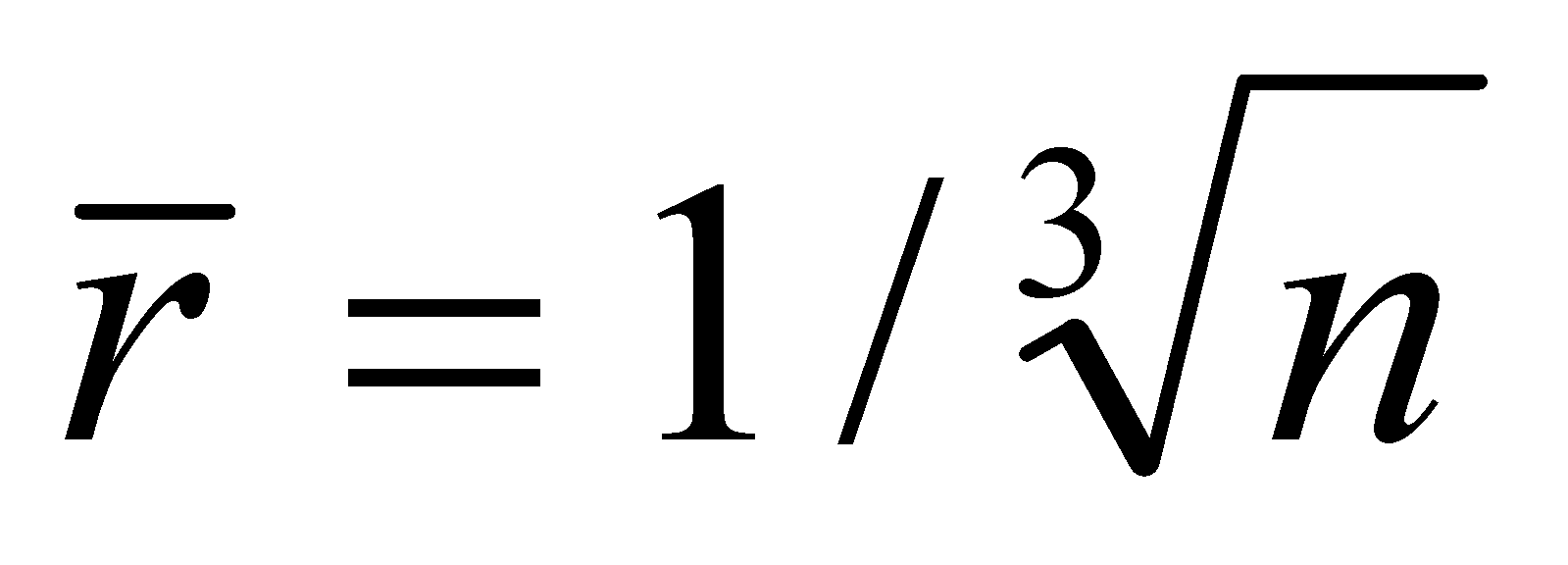
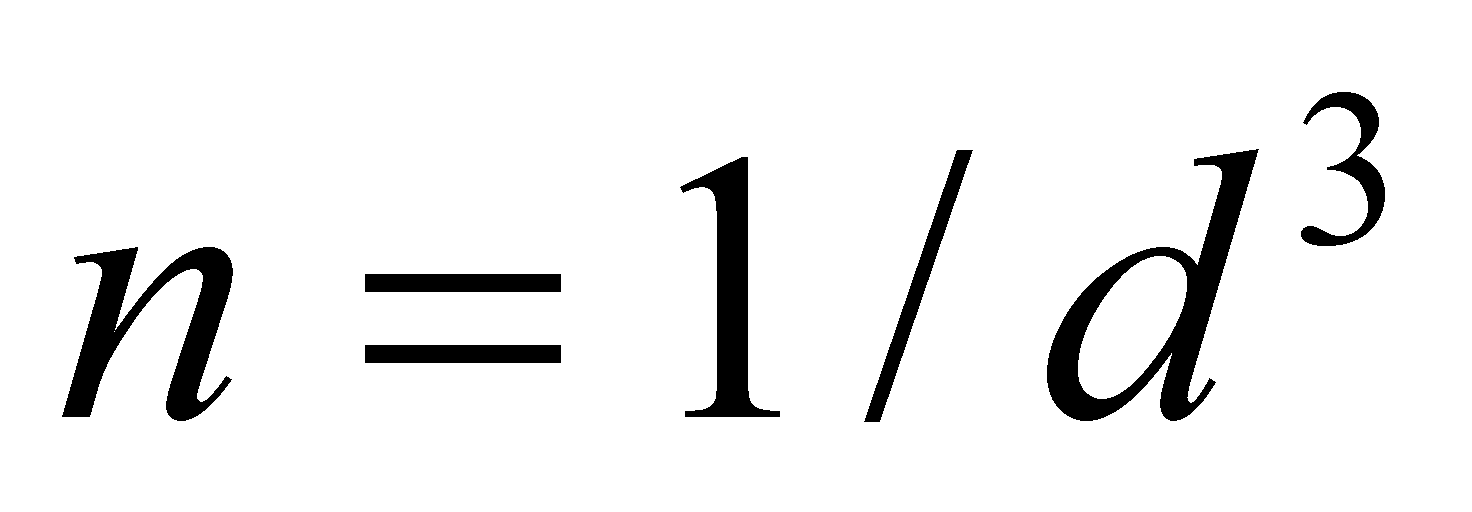
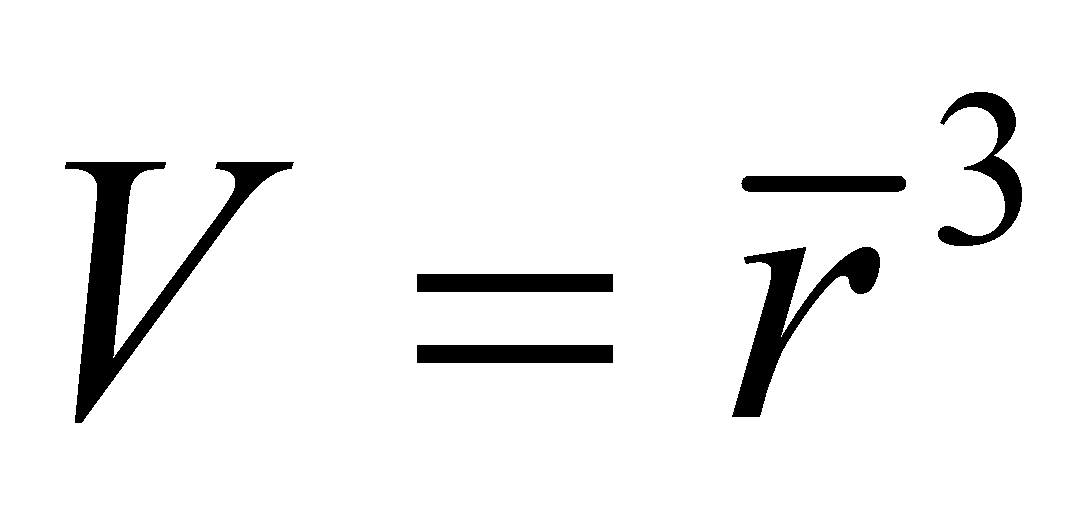 Для вывода кинетического уравнения Больцмана рассмотрим одноатомный идеальный газ, т.е. достаточно разряженный газ, состоящий из электрически нейтральных атомов или молекул. Единственным видом взаимодействия между частицами идеального газа являются столкновения между молекулами, происходящие, однако, настолько редко, что каждая молекула почти всё время движется как свободная
. Рассматривая частицы газа как классические, можно утверждать, что на одну частицу приходиться объём . Число частиц в единице объёма есть концентрация . Значит среднее расстояние между частицами есть ( предполагается достаточно большим по сравнению с радиусом действия межмолекулярных сил d). При получении уравнения Больцмана сделаем следующие предположения:
Для вывода кинетического уравнения Больцмана рассмотрим одноатомный идеальный газ, т.е. достаточно разряженный газ, состоящий из электрически нейтральных атомов или молекул. Единственным видом взаимодействия между частицами идеального газа являются столкновения между молекулами, происходящие, однако, настолько редко, что каждая молекула почти всё время движется как свободная
. Рассматривая частицы газа как классические, можно утверждать, что на одну частицу приходиться объём . Число частиц в единице объёма есть концентрация . Значит среднее расстояние между частицами есть ( предполагается достаточно большим по сравнению с радиусом действия межмолекулярных сил d). При получении уравнения Больцмана сделаем следующие предположения:
- частицы газа неразличимы (одинаковы);
- частицы сталкиваются только попарно (пренебрегаем столкновением одновременно трех и более частиц);
- непосредственно перед столкновением частицы движутся по одной прямой навстречу друг другу;
- столкновение молекул есть прямой центральный упругий удар;
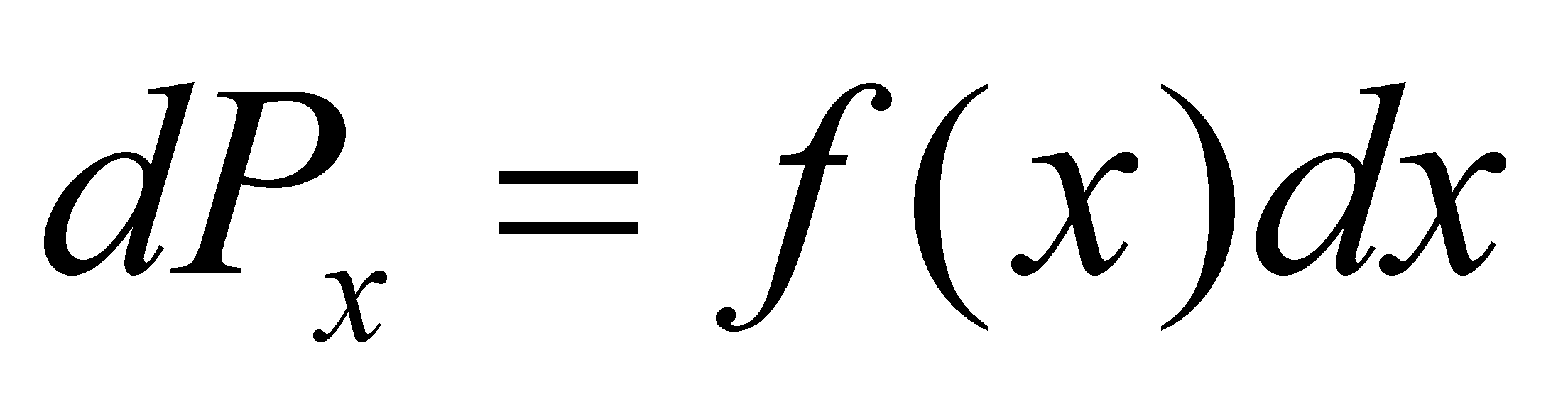
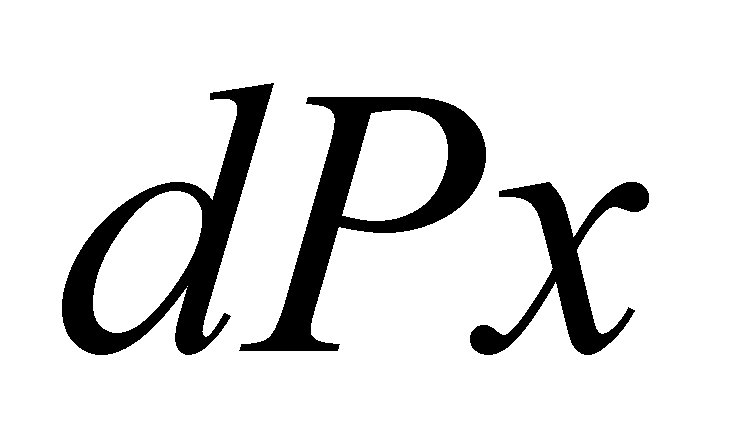
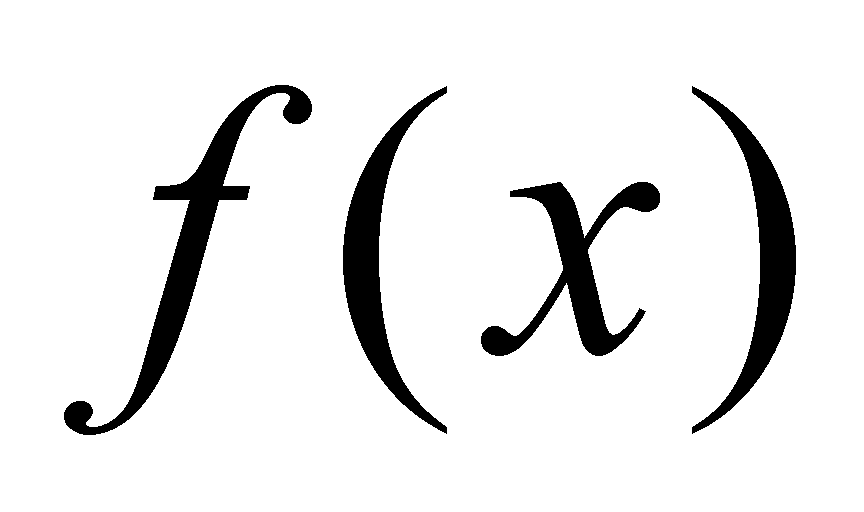
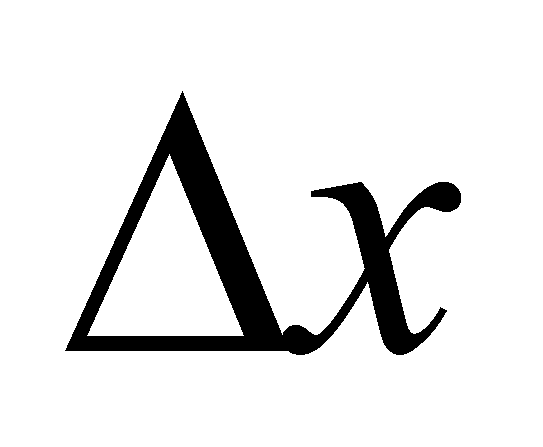
Статистическое описание газа осуществляется функцией распределения вероятности (или плотностью вероятности), причём функция распределения не меняется на расстояниях порядка области столкновения частиц. Плотность вероятности определяет вероятность того, что некоторая случайная величина x имеет значение в пределах малого интервала dx следующим образом . Вероятность нахождения величины x в конечном интервале определяется интегрированием .
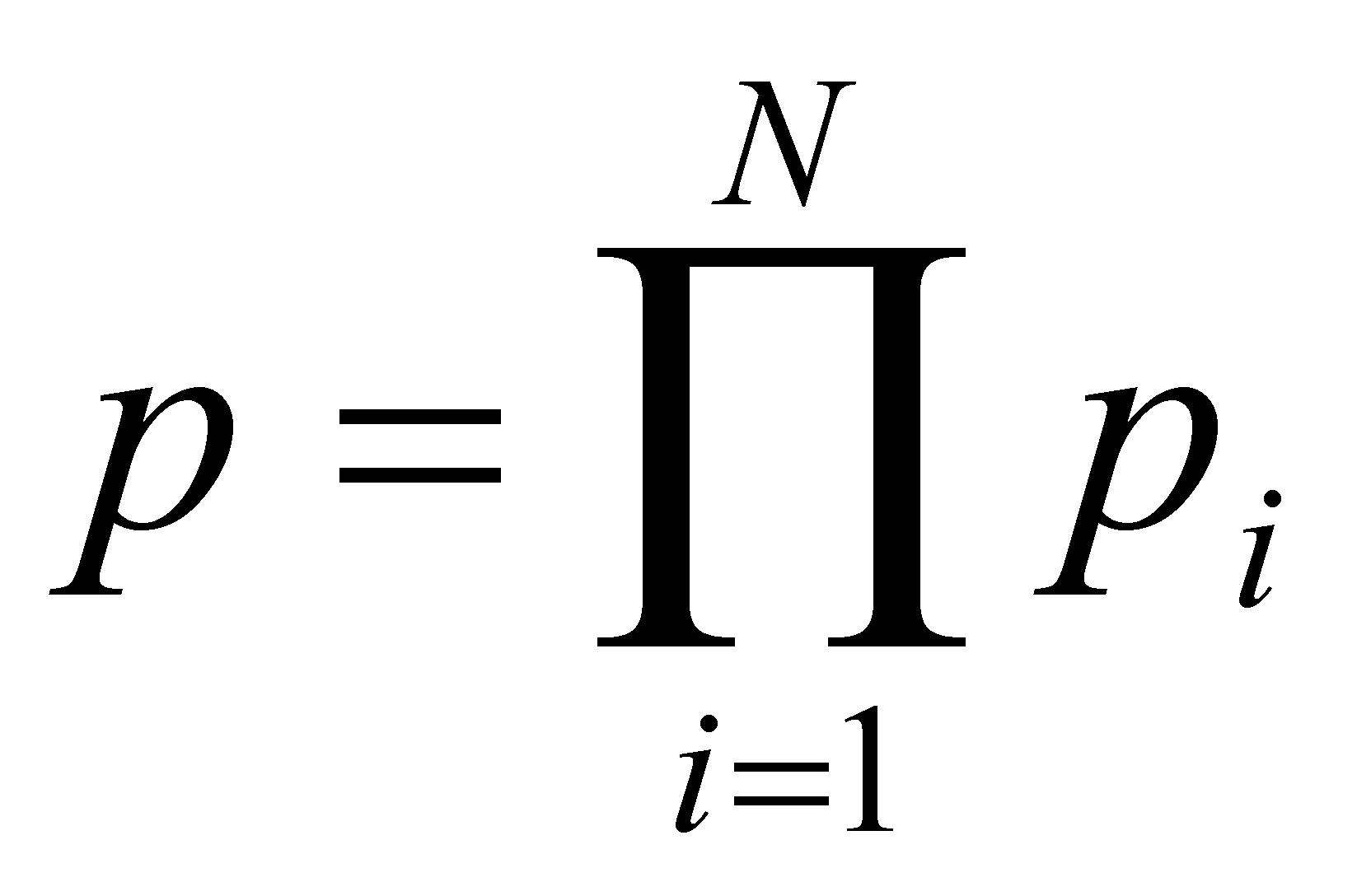
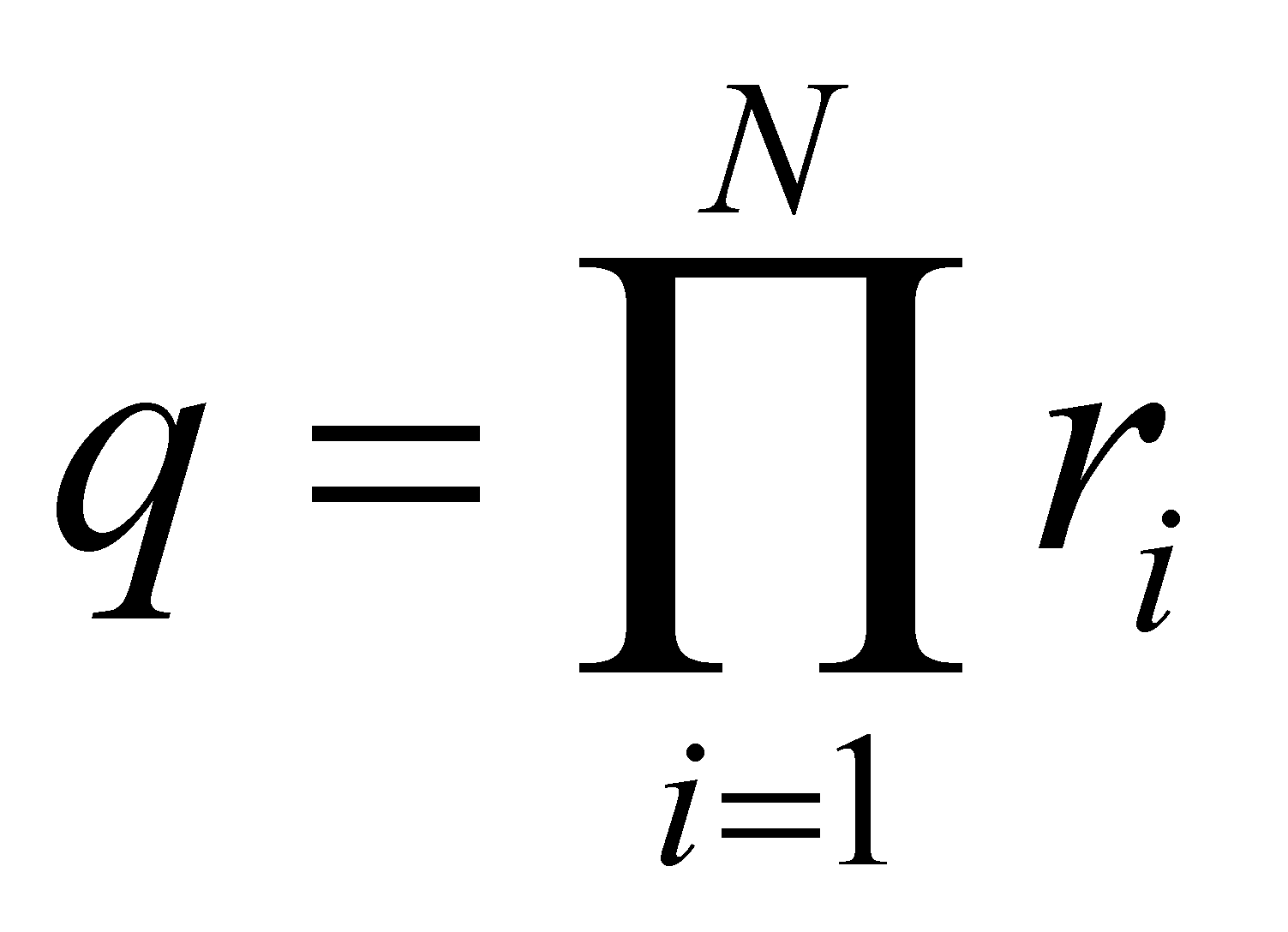
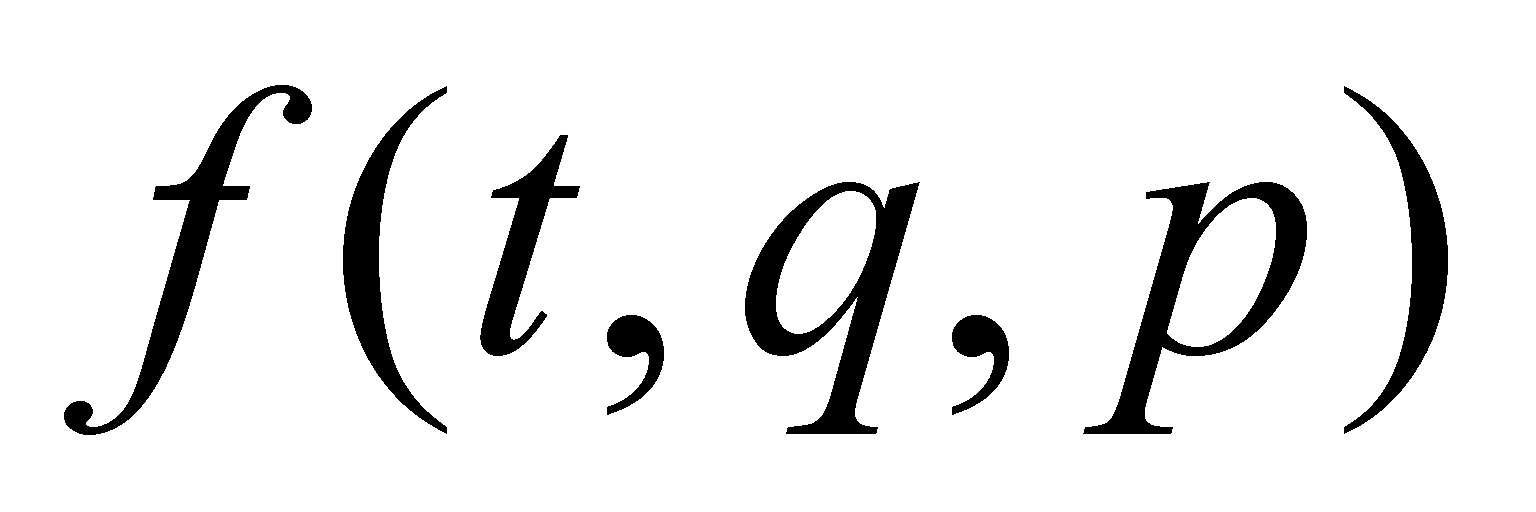
Функция распределения молекул газа даётся в их фазовом
:
-пространстве.
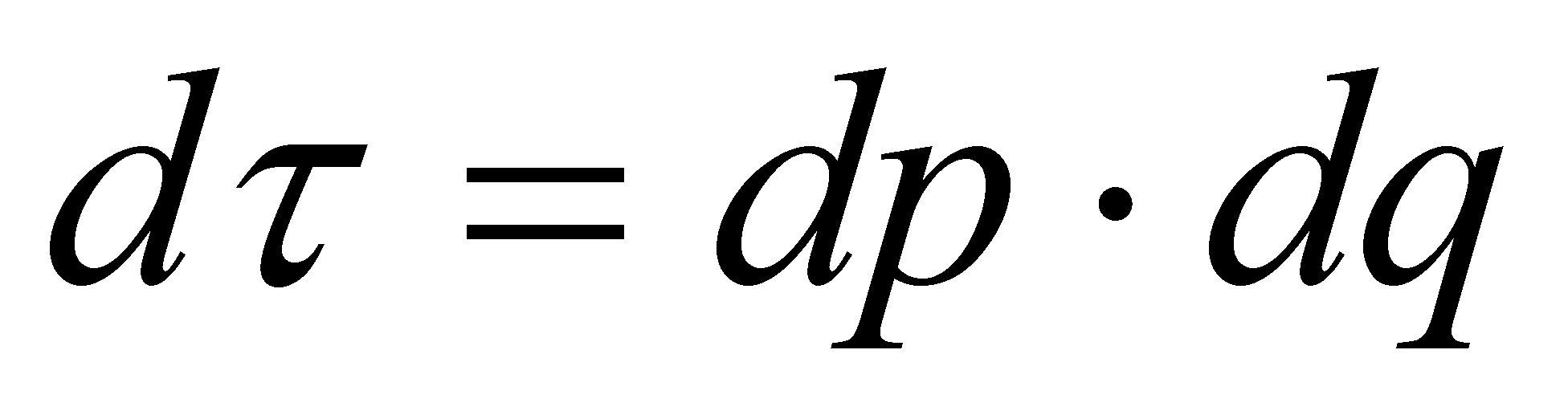
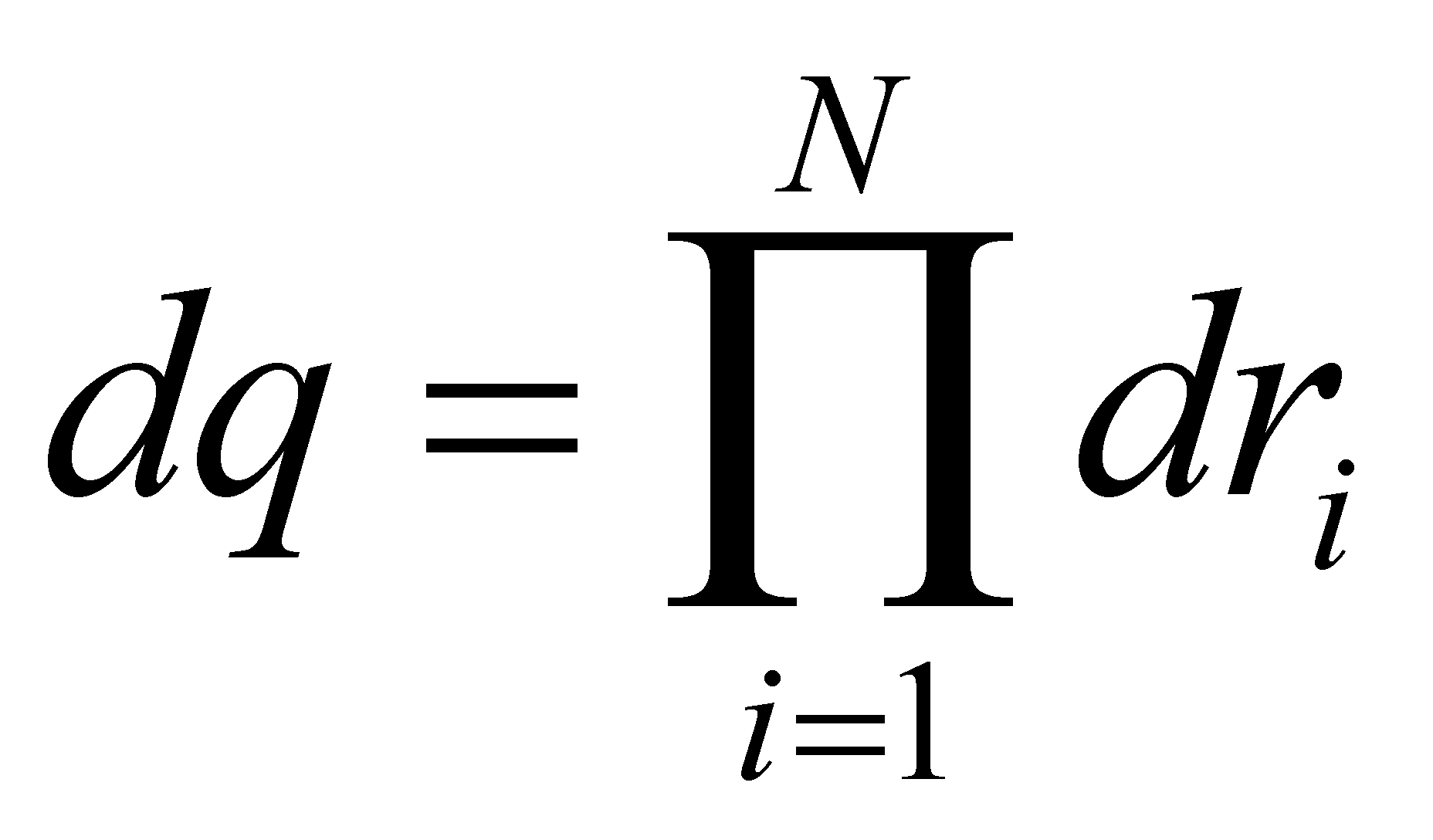
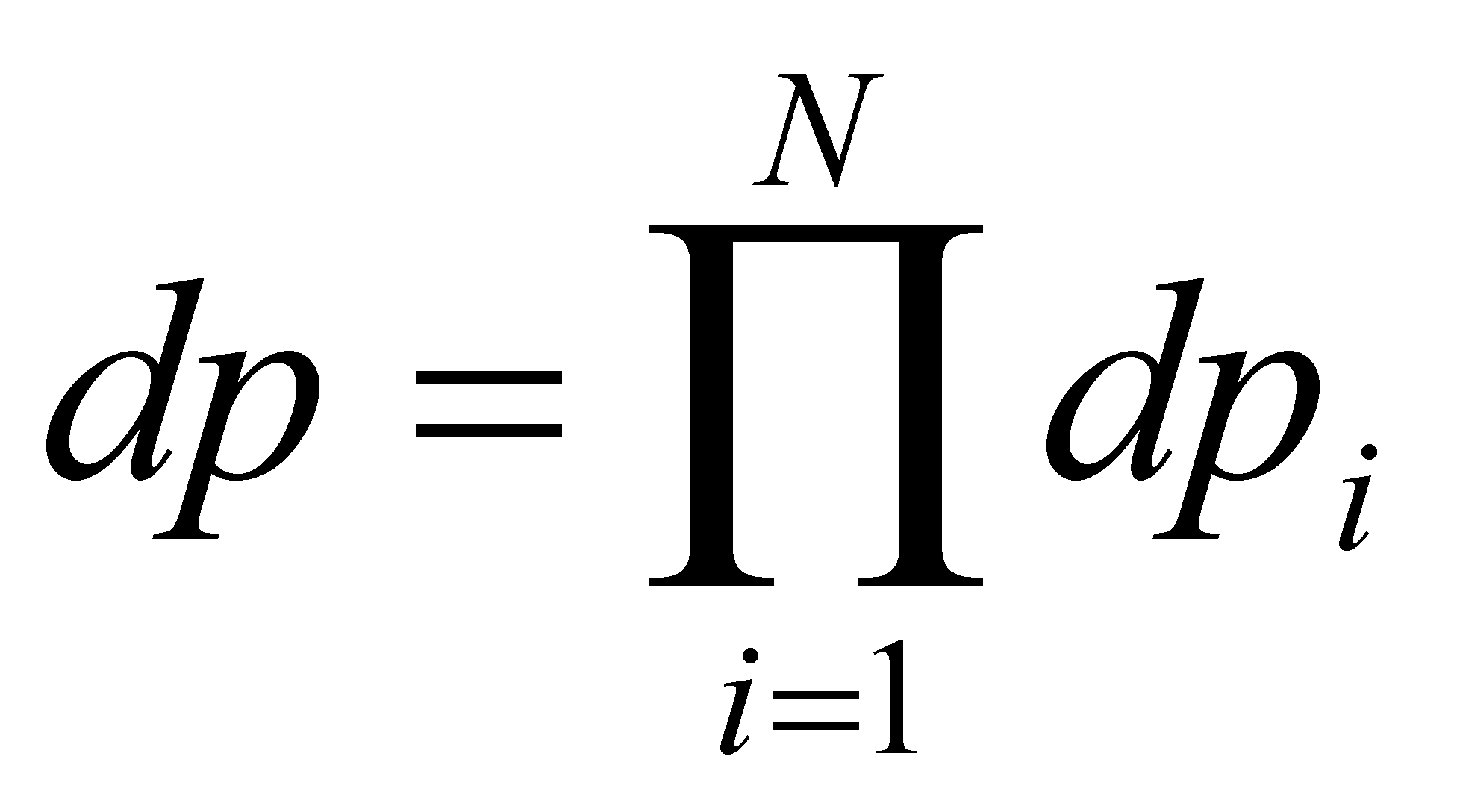
есть совокупность обобщённых координат всех молекул; - совокупность обобщённых импульсов молекул. Соответственно
и . Обозначим через
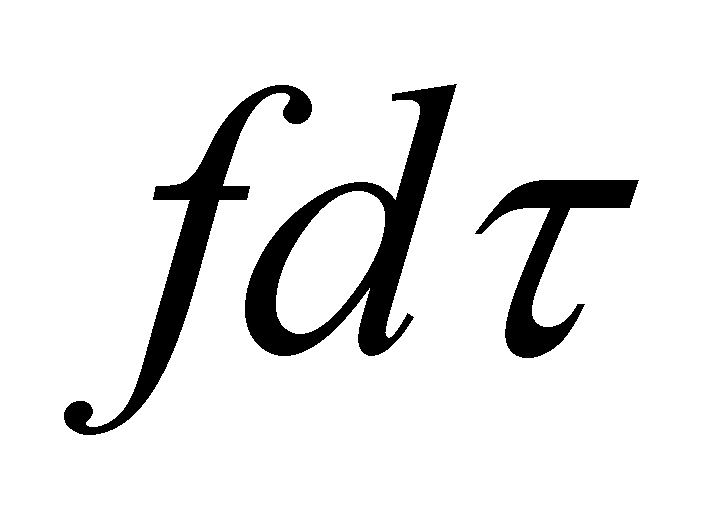
элемент объёма фазового пространства молекулы. В заданном элементе фазового пространства находиться (в среднем) число частиц , равное (т.е. рассматриваются молекулы, значения q и p которых лежат в выделенных интервалах dq и dp). Функция распределения молекул газа выше была определена в фазовом пространстве, тем не менее, она может быть выражена через иные переменные, отличные от обобщённых координат и импульсов частицы. Произведём выбор аргументов функции f.

Рассматривая неравновесный, протекающий во времени, процесс изменения состояния системы, мы очевидно должны считать, что функция распределения зависит от времени. Рассматриваемый газ есть множество частиц, которые мы условились считать классическими.
Поступательное движение классической частицы описывается координатами

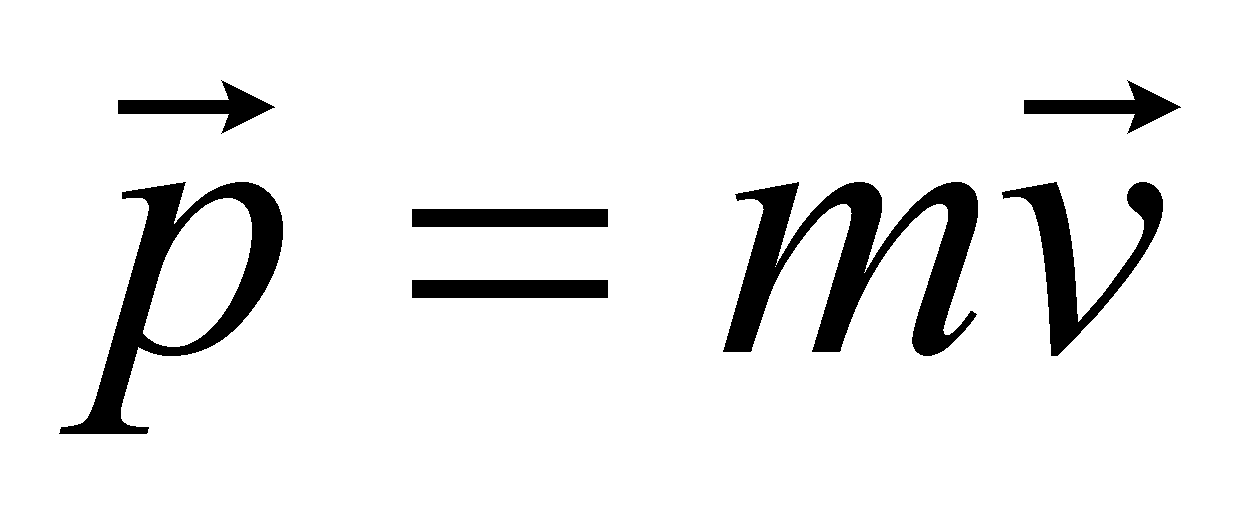
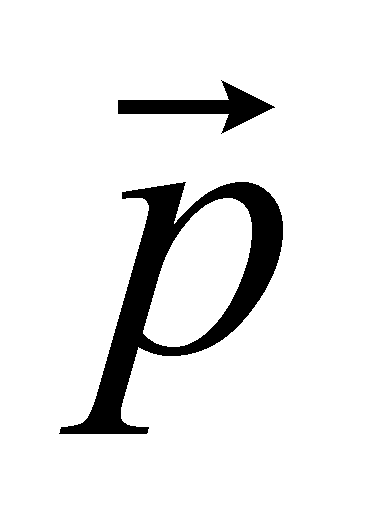

центра тяжести частица и вектором скорости или вектором импульса ( , где m – масса частицы). Для одноатомного газа поступательное движение – единственный вид движения частиц; число степеней свободы равно трём. Если частица представляет собой многоатомную молекулу, то возникают дополнительные степени свободы, связанные с вращением молекулы в пространстве и колебанием атомов в молекуле. Условиями применения квантовой механики являются малые массы и высокие концентрации частиц, а так же низкие температуры. Не рассматривая область низких температур, будем считать вращательное движение молекул газа классическим. Любое классическое вращательное движение описывается, прежде всего, вращательным моментом сил, действующих на тело. Под действием момента двухатомная молекула приходит во вращение в плоскости, перпендикулярной вектору момента. Кроме того, положение молекулы характеризуется углом поворота оси молекулы в плоскости вращения.
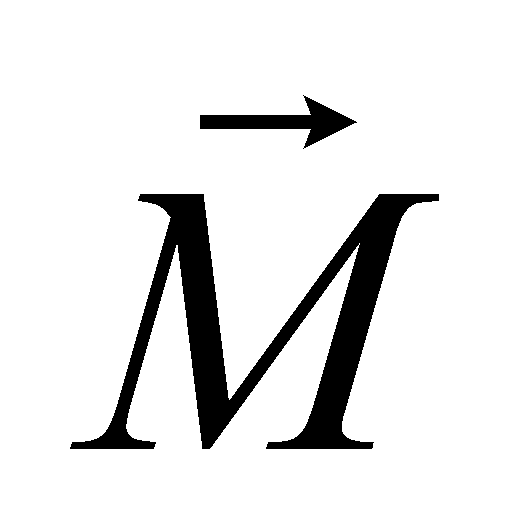
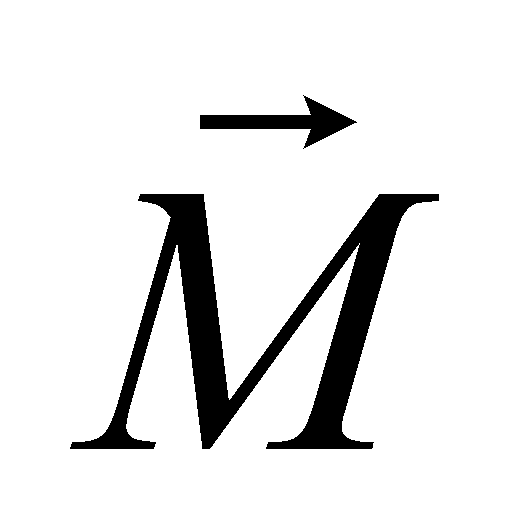
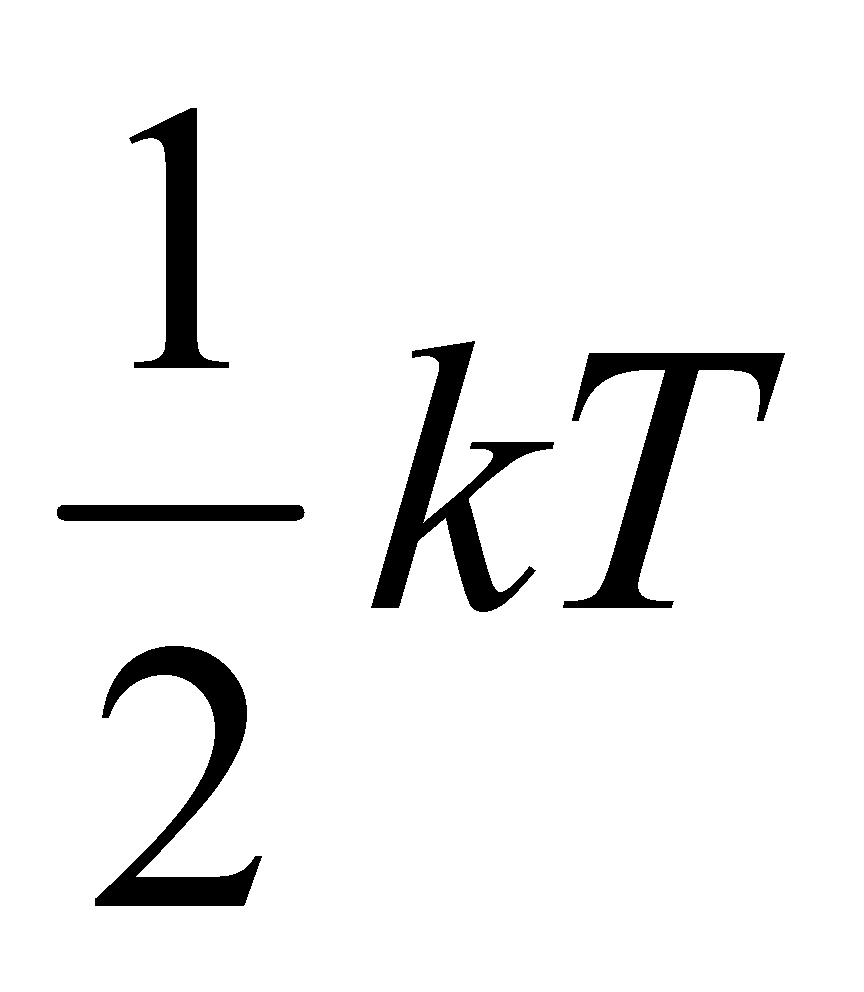
Рассмотрим молекулу водорода (или любую другую двухатомную молекулу) при Т=300 К. Согласно закону равнораспределения на каждую степень свободы (поступательную, вращательную или колебательную) в среднем приходится одинаковая кинетическая энергия, равная .
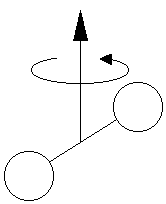

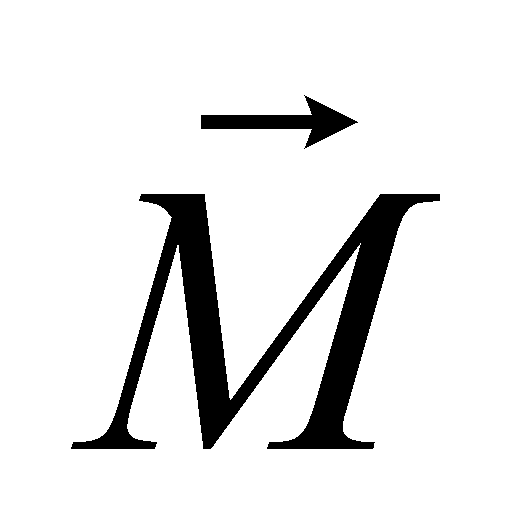
Пусть I - момент инерции молекулы, m - масса, d - среднее расстояние между атомами в молекуле.
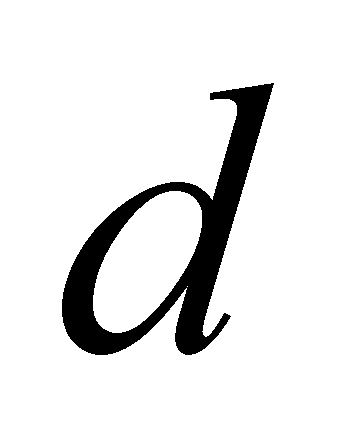

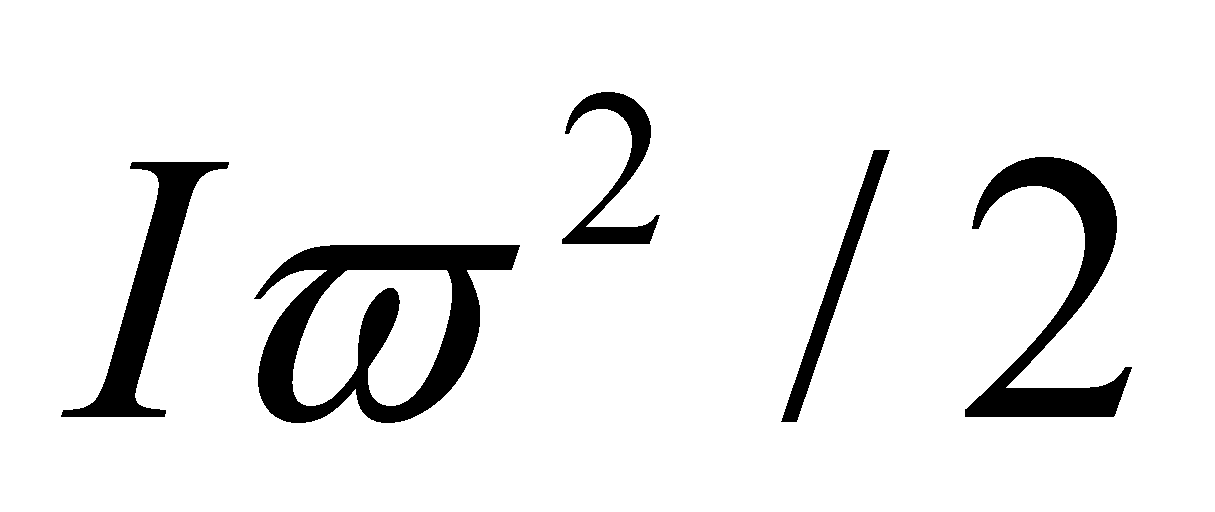
- средняя кинетическая энергия вращения молекулы;
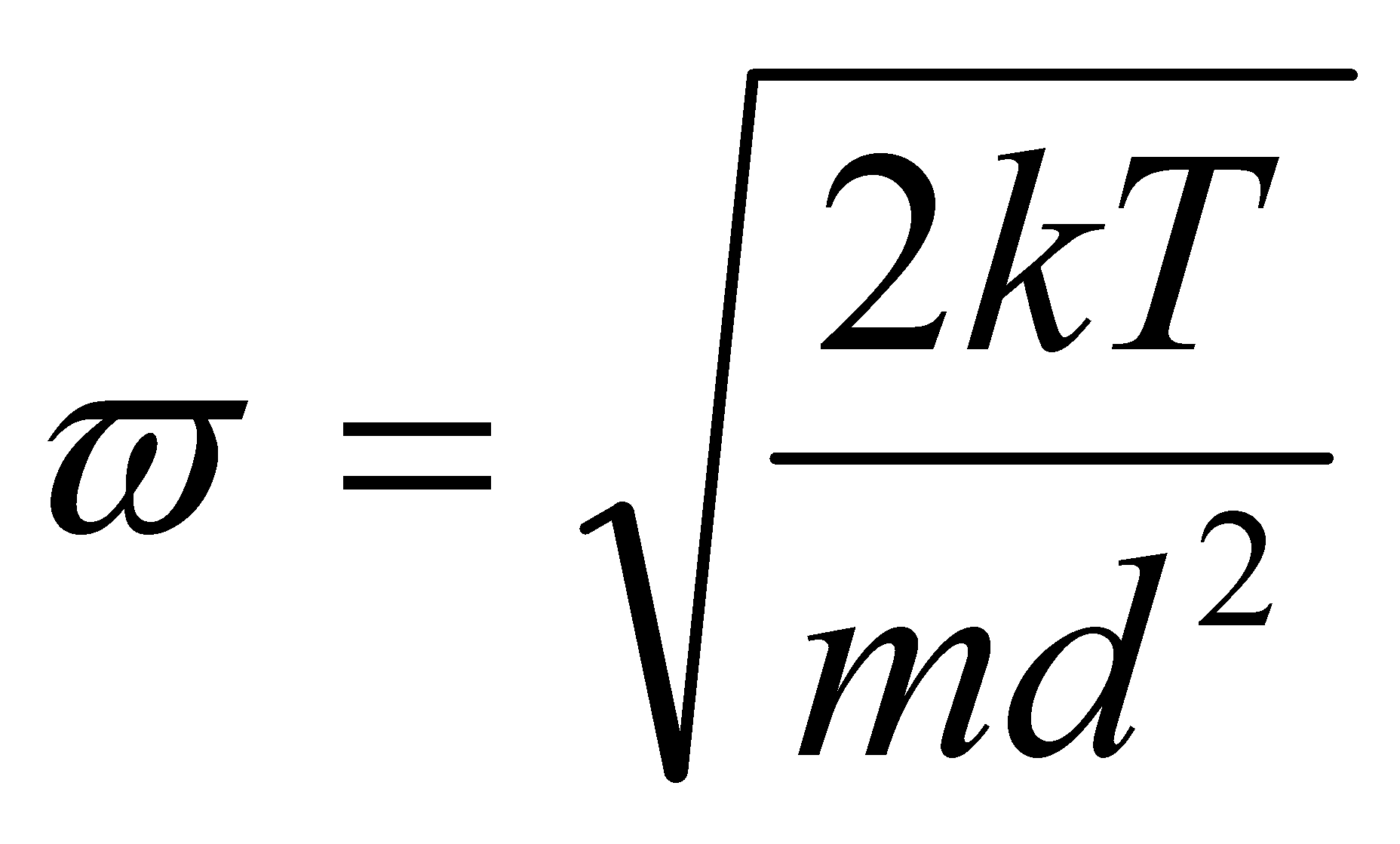
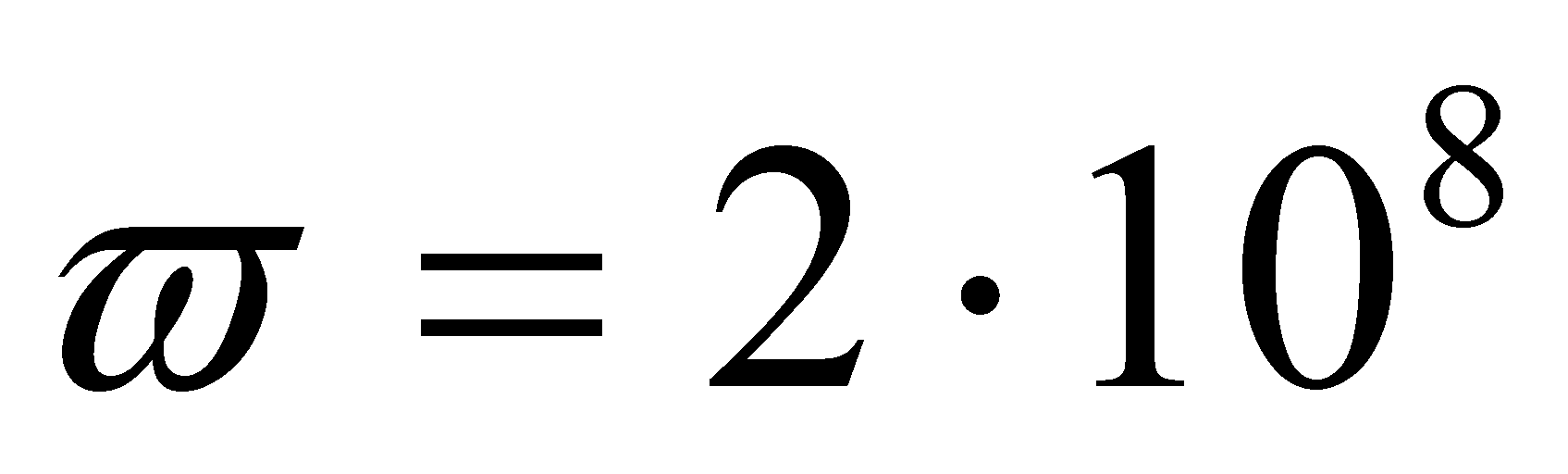
(рад/c)
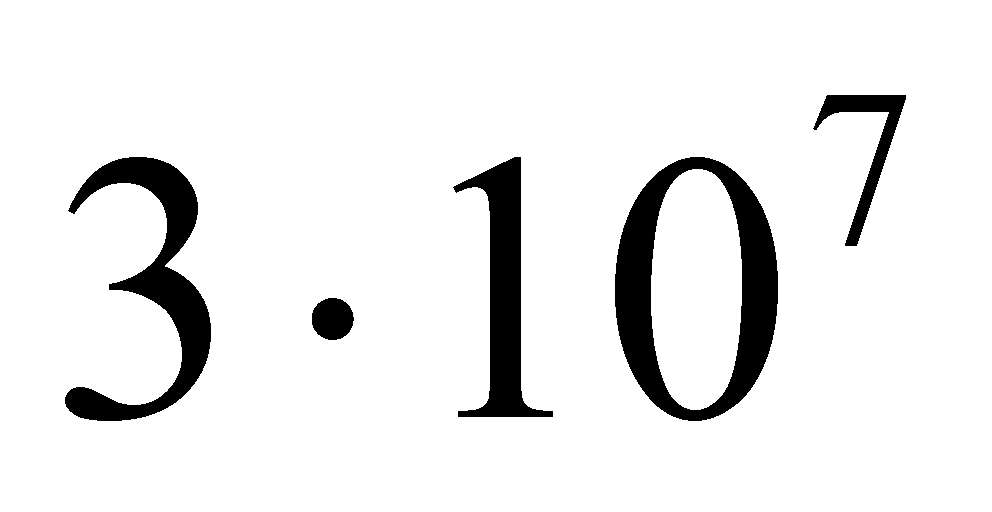
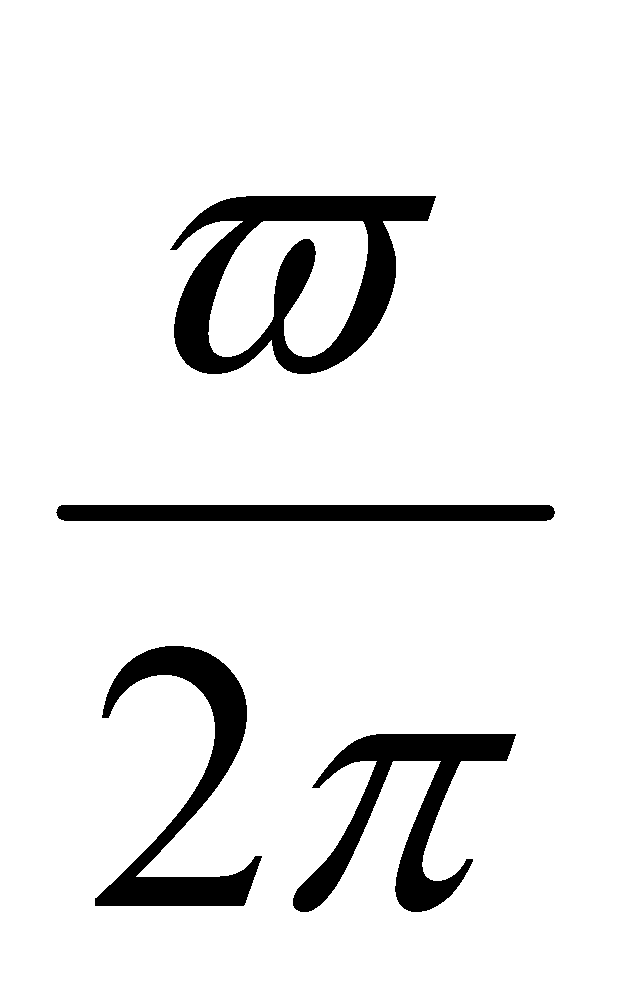
За одну секунду молекула делает (т.е. приблизительно ) полных оборота. Скорость изменения угла поворота оси двухатомной молекулы велика и все возможные ориентации молекулы в плоскости вращения будут равновероятными. Тогда при рассмотрении реальных физических задач функцию распределения можно считать не зависящей от ориентации молекулы. Закон равнораспределения справедлив и для многоатомных молекул, а значит сделанное предположение о независимости функции распределения от ориентации молекул газа в пространстве можно считать справедливым для многоатомных газов.
Колебательное движение атомов внутри молекулы практически всегда квантуется и состояние молекулы как квантовой системы должно определяться квантовыми параметрами. В обычных условиях (при не слишком высоких температурах) молекула газа находятся в невозбужденном состоянии, отвечающем основному (нулевому) колебательному уровню. Поэтому квантовыми эффектами в реальных газах при обычных условиях можно пренебречь. Следовательно, функция распределения классического идеального газа в неравновесном состоянии зависит не только от времени, но и от координат частиц .
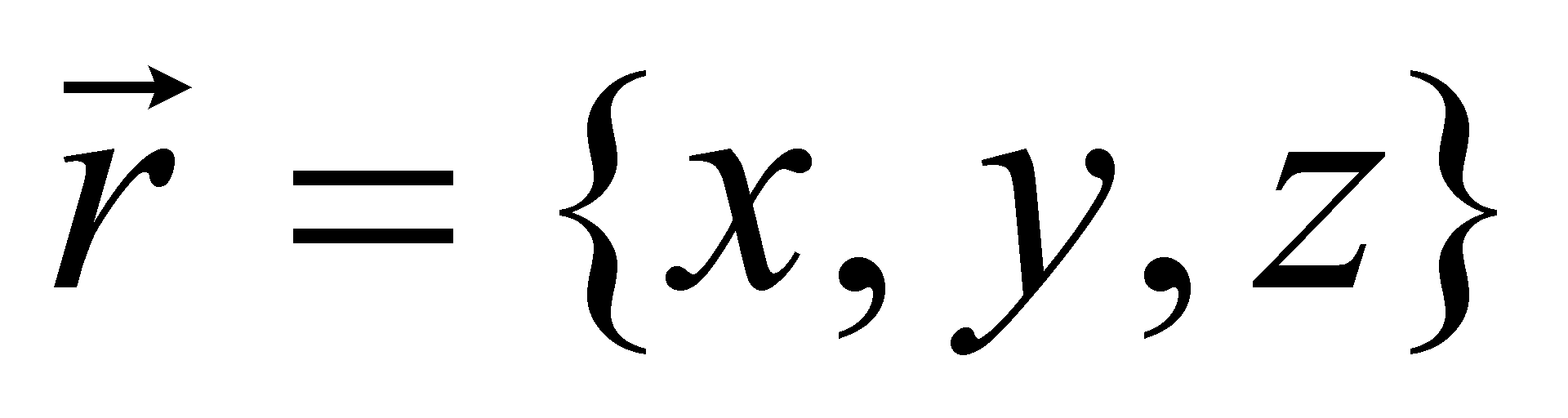
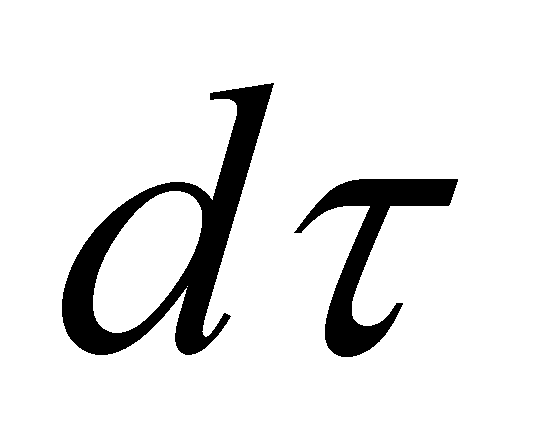
Обозначим символом Г совокупность всех переменных, от которых зависит функция распределения, за исключением координат молекулы и времени. В элементе фазового объёма выделим элементарный объём трёхмерного пространства , а остальную его часть обозначим символом dГ. Величины dГ есть интегралы движения, которые остаются постоянными для любой молекулы в течение её свободного движения между двумя последовательными столкновениями. Свободное движение молекулы осуществляется без внешнего воздействия со стороны каких-либо внешних тел или полей. В результате взаимодействия молекул друг с другом (в случае столкновении) или под воздействием поля
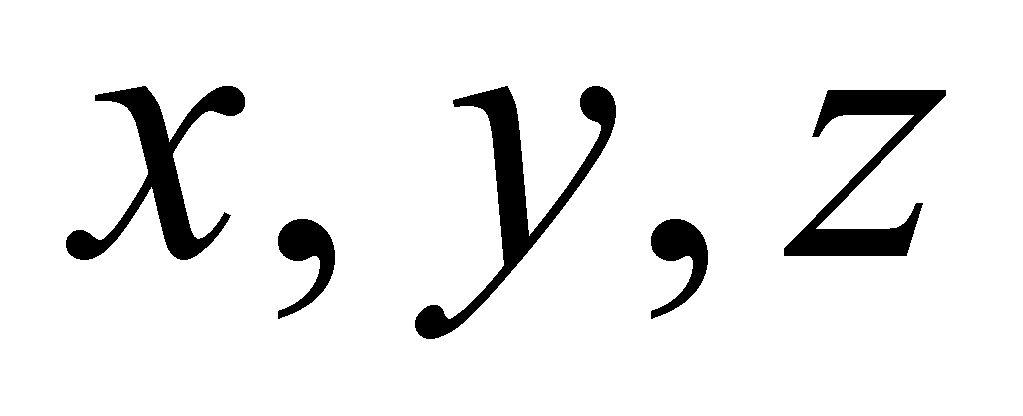
эти величины вполне могут измениться. Координаты молекулы, как целого, меняются в течение её свободного движения.
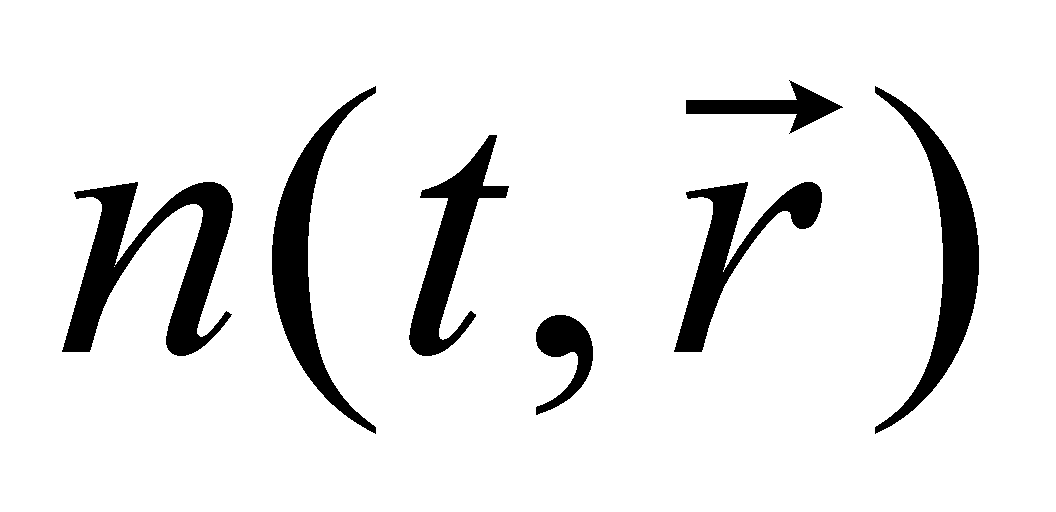
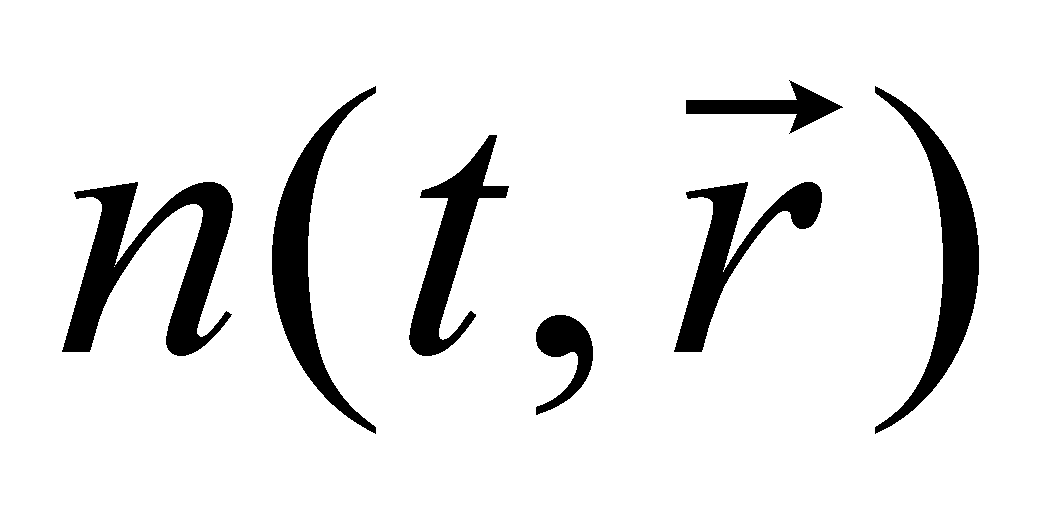
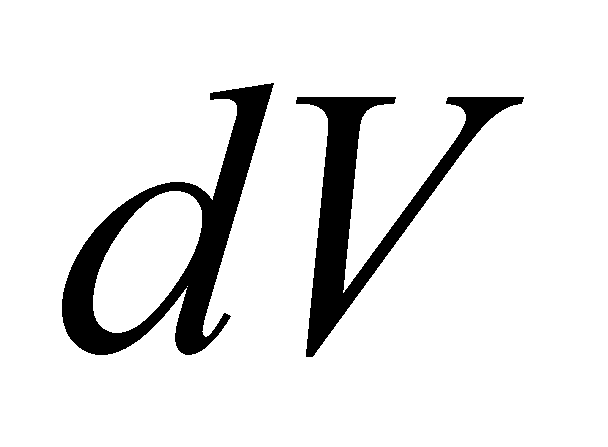
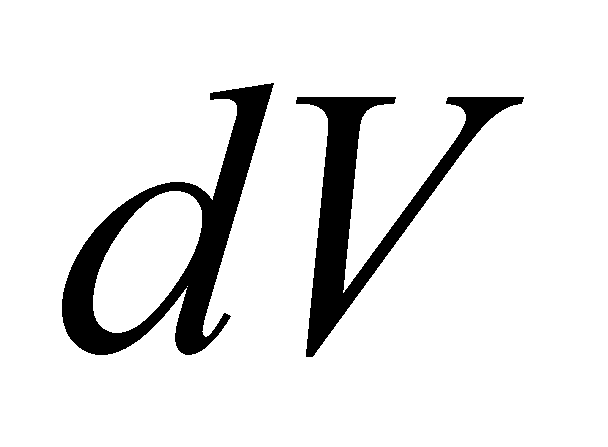
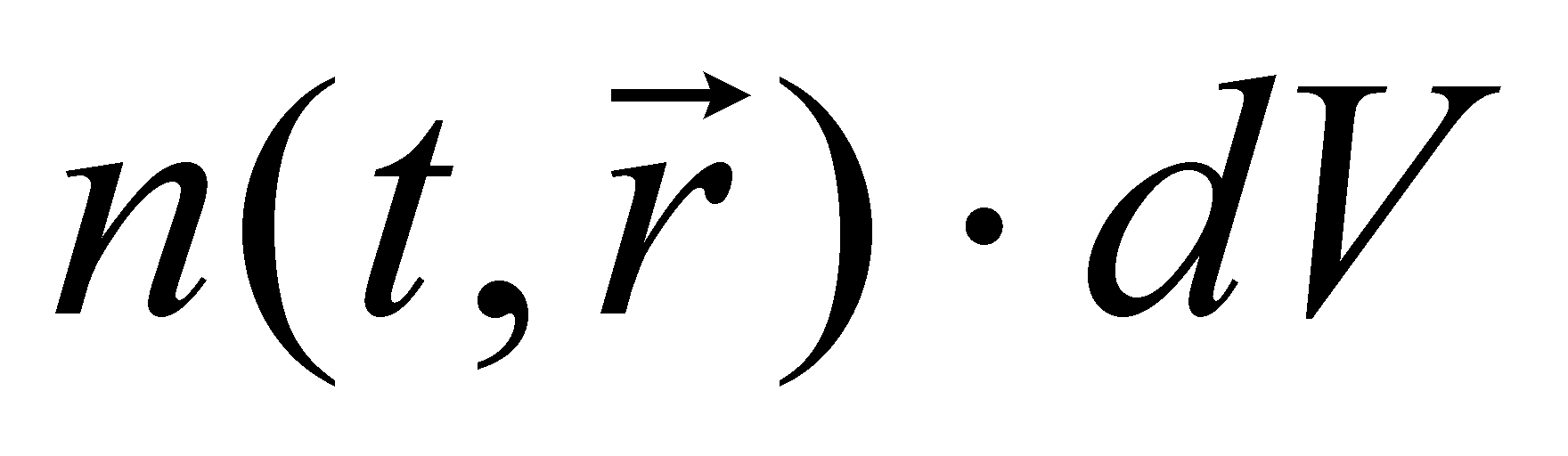
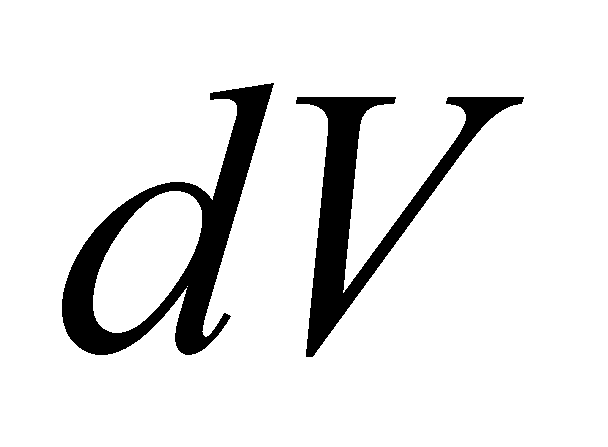
Концентрация или плотность пространственного распределения частиц газа может быть выражена интегралом , а среднее число частиц в элементе объёма определяется произведением . Под элементом объёма подразумевается физически малый объём , т.е. участок пространства, размеры которого малы по сравнению с размерами, рассматриваемыми в задаче. В то же время размеры малого объёма велики по сравнению с размерами молекул. Утверждение о нахождении молекулы в данном элементе объёма определяет положение молекулы в лучшем случае лишь с точностью до расстояний, превышающих размеры самой молекулы. Точное определение координат двух классических частиц даёт возможность точного определения их траекторий до и после столкновения, если оно имело место. Неопределенность же точного взаимного положения частиц даёт возможность применять вероятностный подход к решению задачи об их столкновении. Рассмотрение классического газа подразумевает то, что плотность
является макроскопической величиной. Макроскопичность имеет место лишь в том случае, когда элементарный объём содержит достаточно большое число частиц ( только тогда изменение числа частиц в элементарном объёме мало в течение рассматриваемого процесса); при этом линейные размеры области, занимаемой газом, должны быть значительно больше среднего межмолекулярного расстояния.
§
2 Столкновение частиц.
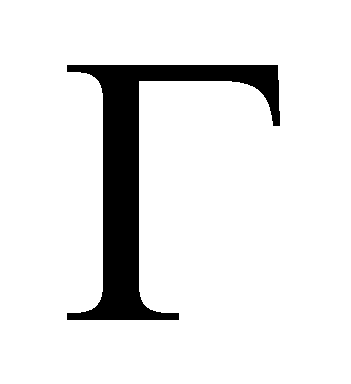
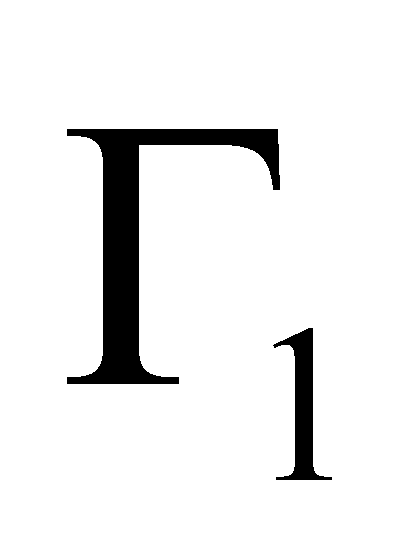
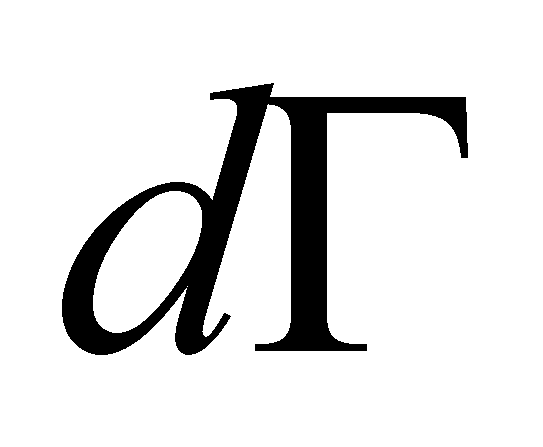
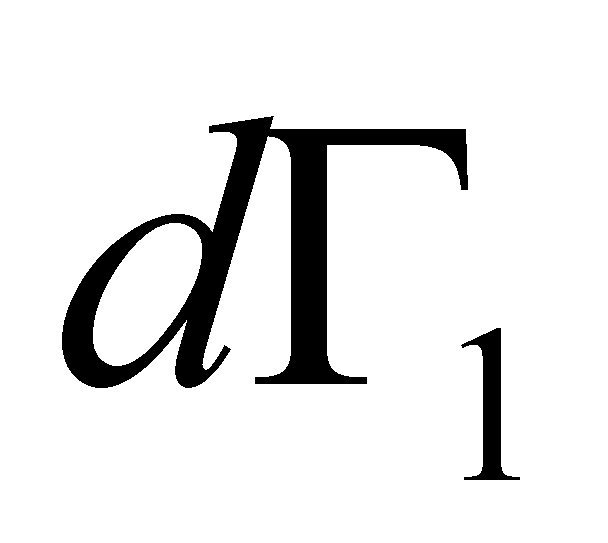

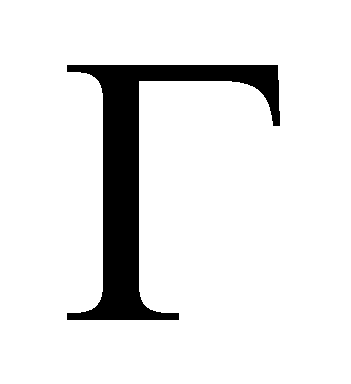
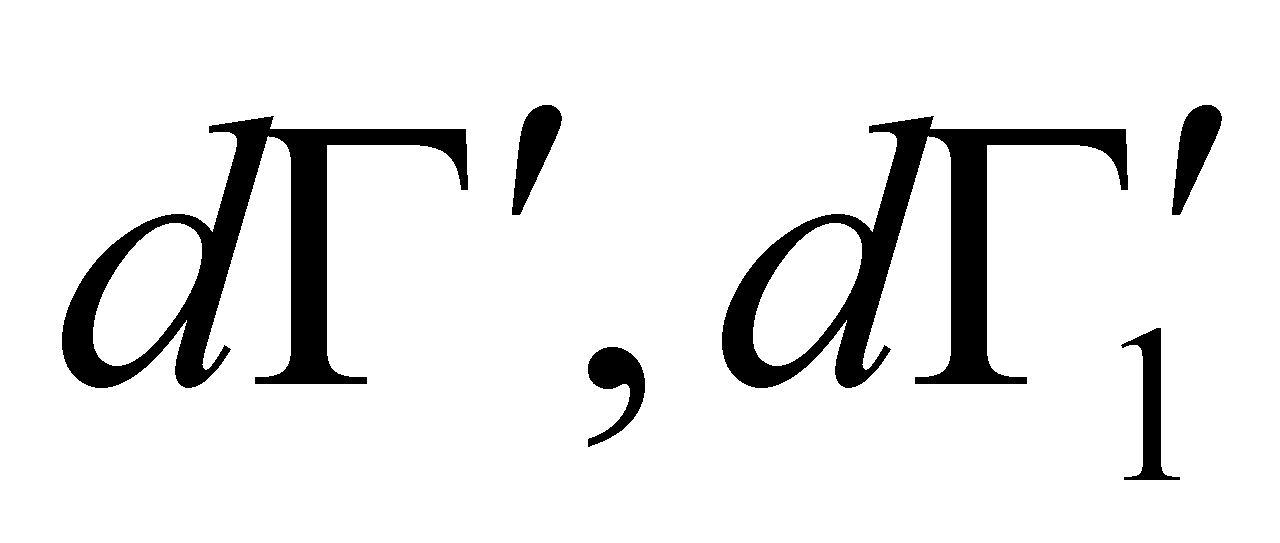
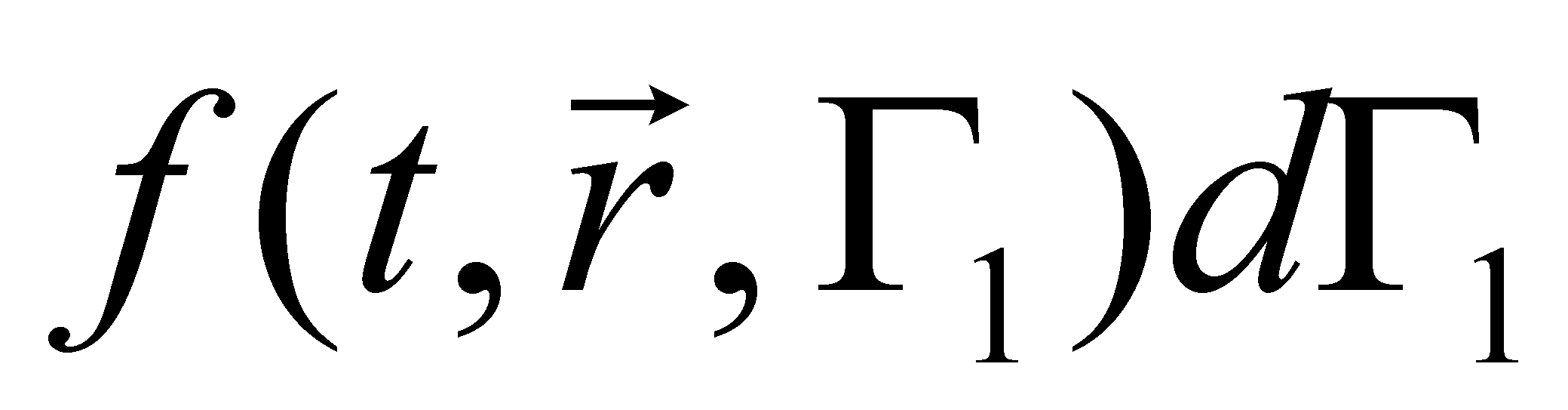
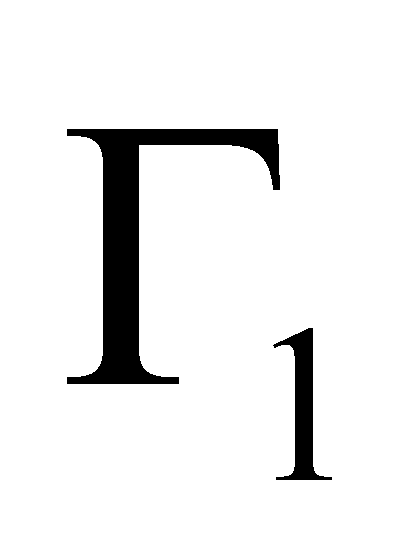
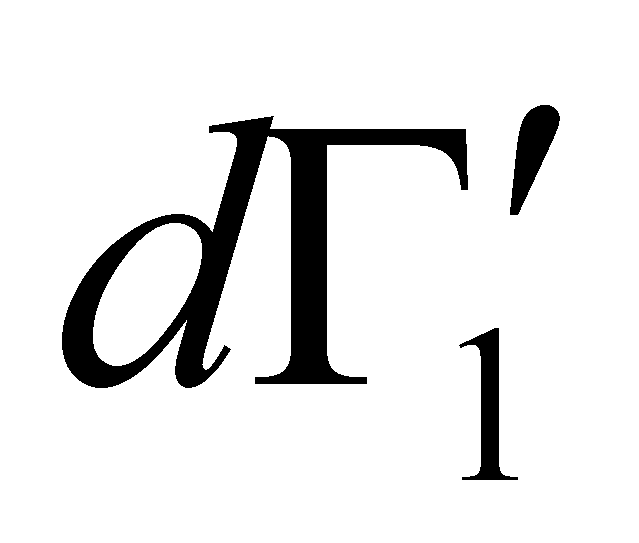
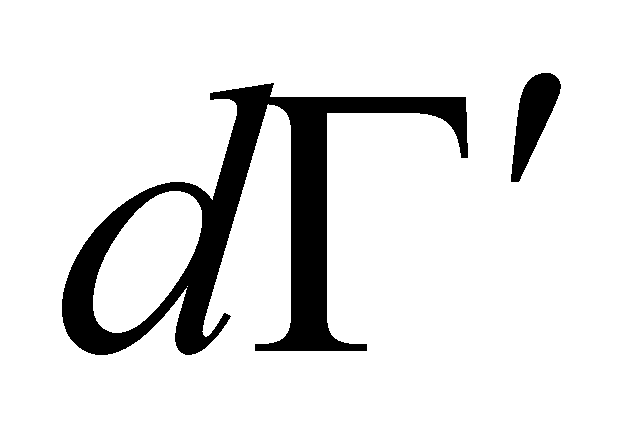
Рассмотрим столкновение молекул, одни из которых обладают значениями величин Г, лежащими в заданном интервале , а другие – в интервале . В результате столкновения молекулы приобретают значения величин Г в интервалах соответственно и . Далее для краткости будем говорить о столкновении молекул и с переходом
Произведение числа молекул в единице объёма на вероятность каждой молекулы испытать столкновение с указанным переходом даст полное число таких столкновений, отнесённое к единице объёма в единицу времени. Вероятность такого события (обозначим её через некоторую функцию ) пропорциональна числу молекул в единице объёма и интервалам значений величин каждой из молекул после столкновения. Таким образом, будем считать, что , а число столкновений с переходом , происходящих в единице объёма в единицу времени примет вид
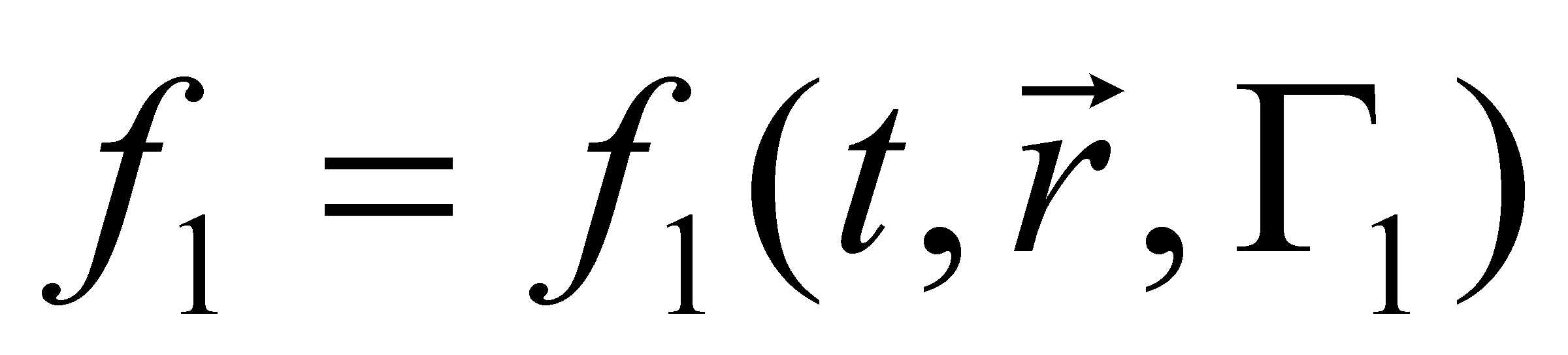
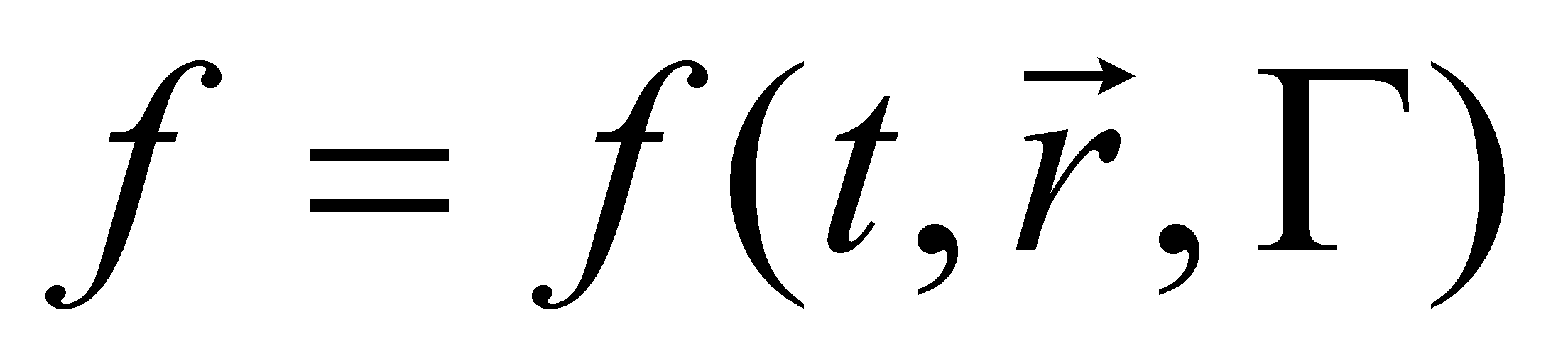
( штрихом обозначены конечные состояния, без штриха - начальные). Вероятность столкновения обладает важным свойством, которое следует из законов механики, относительно обращения знака времени. Если обозначить верхним индексом Т значения всех величин, получившихся при обращении знака времени, то будет иметь место равенство
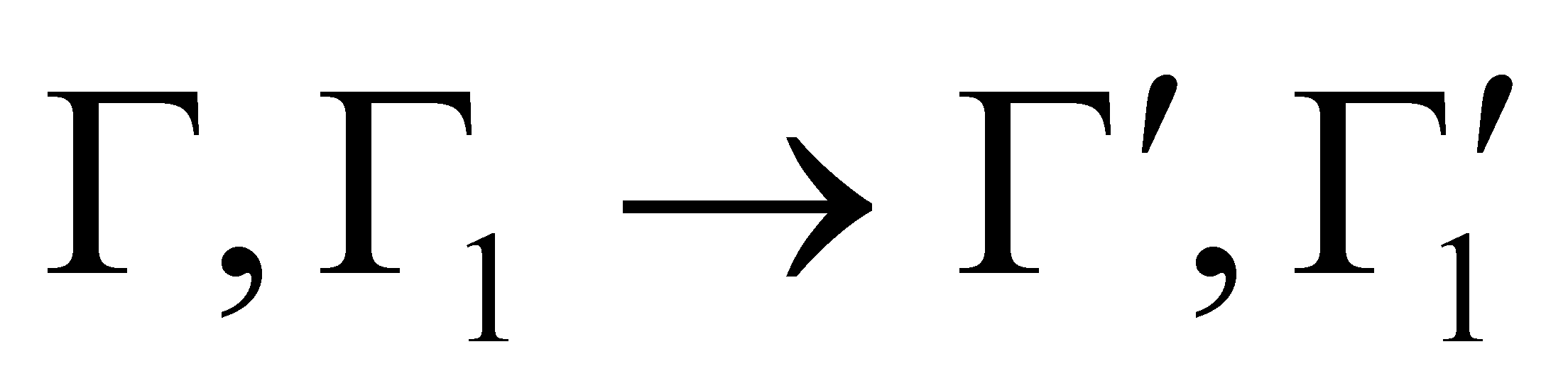
Обращение времени переставляет состояния “до” и ”после”, а значит необходимо переставить местами аргументы функции вероятности. В частности, указанное равенство справедливо в случае равновесия системы, т.е.
можно утверждать, что в равновесии число столкновений с переходом равно числу столкновений с переходом (*)
. Обозначим через равновесную функцию распределения и запишем

(1)
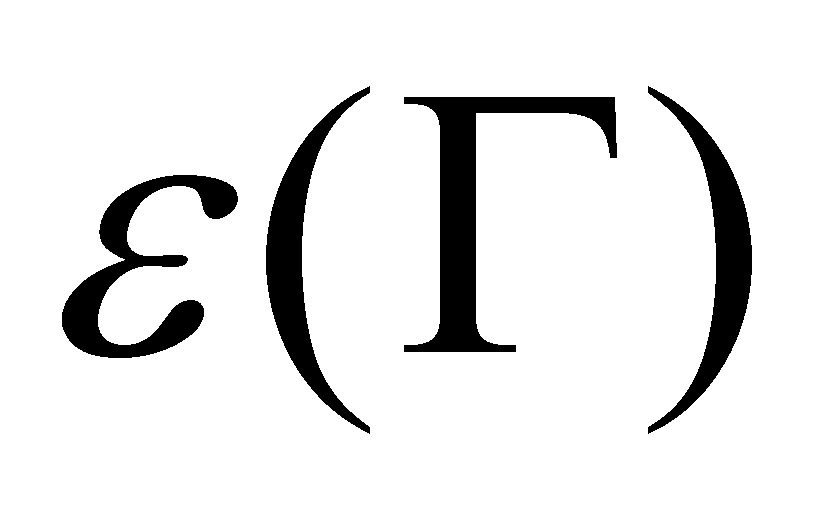
Произведение дифференциалов представляет собой элемент фазового пространства, который не изменяется при обращении времени (дифференциалы в обеих сторонах равенства можно опустить) . Не изменяется так же потенциальная энергия молекул , и, следовательно, равновесная (больцмановская) функция распределения, которая зависит только от енергии :

(2)
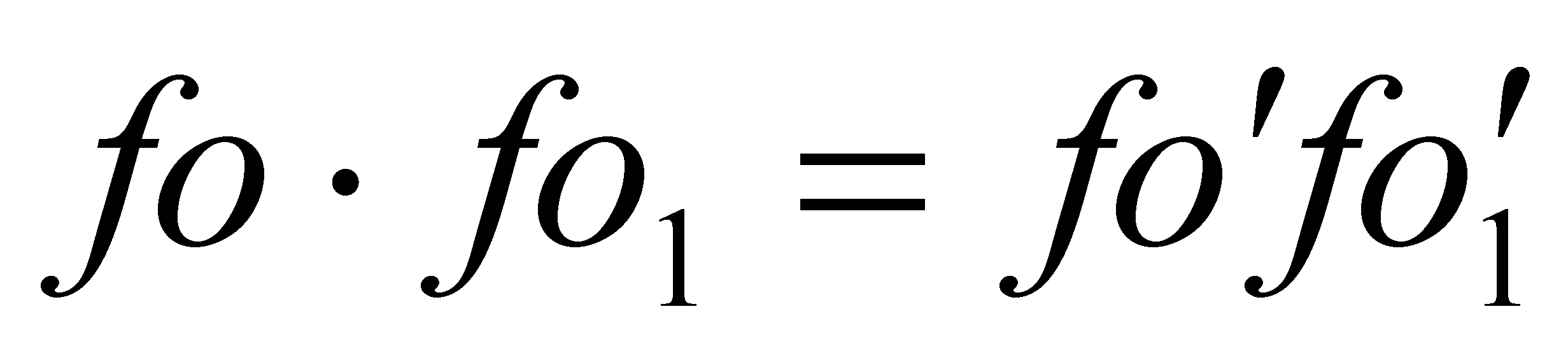
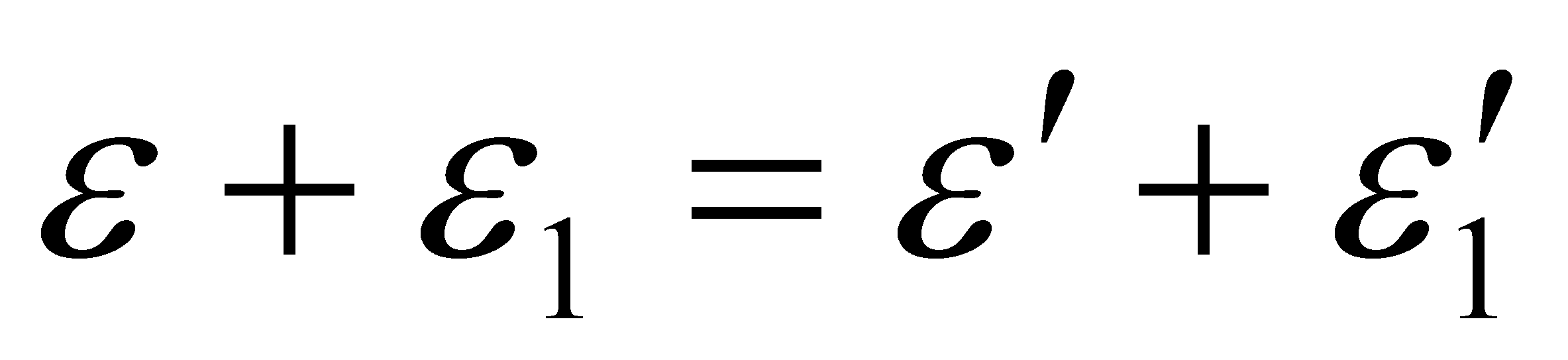
V – макроскопическая скорость движения газа как целого. В силу закона сохранения энергии при столкновении двух молекул . Поэтому можно записать (3)
Отметим ещё тот факт, что сама функция вероятности в принципе может быть определена лишь путём решения механической задачи о столкновении частиц. Написанное выше равенства (1) , (2) и (3) дадут после сокращений в (1)


С учётом утверждения (*)
Интегрируя последнее равенство (для использования в дальнейшем) получаем соотношение:
(4)
§
3
 Вывод кинетического уравнения.
Вывод кинетического уравнения.
Рассмотрим производную от функции распределения по времени:
При движении молекул газа в отсутствии внешнего поля величины Г, как интегралы движения, не изменяются.
(5)
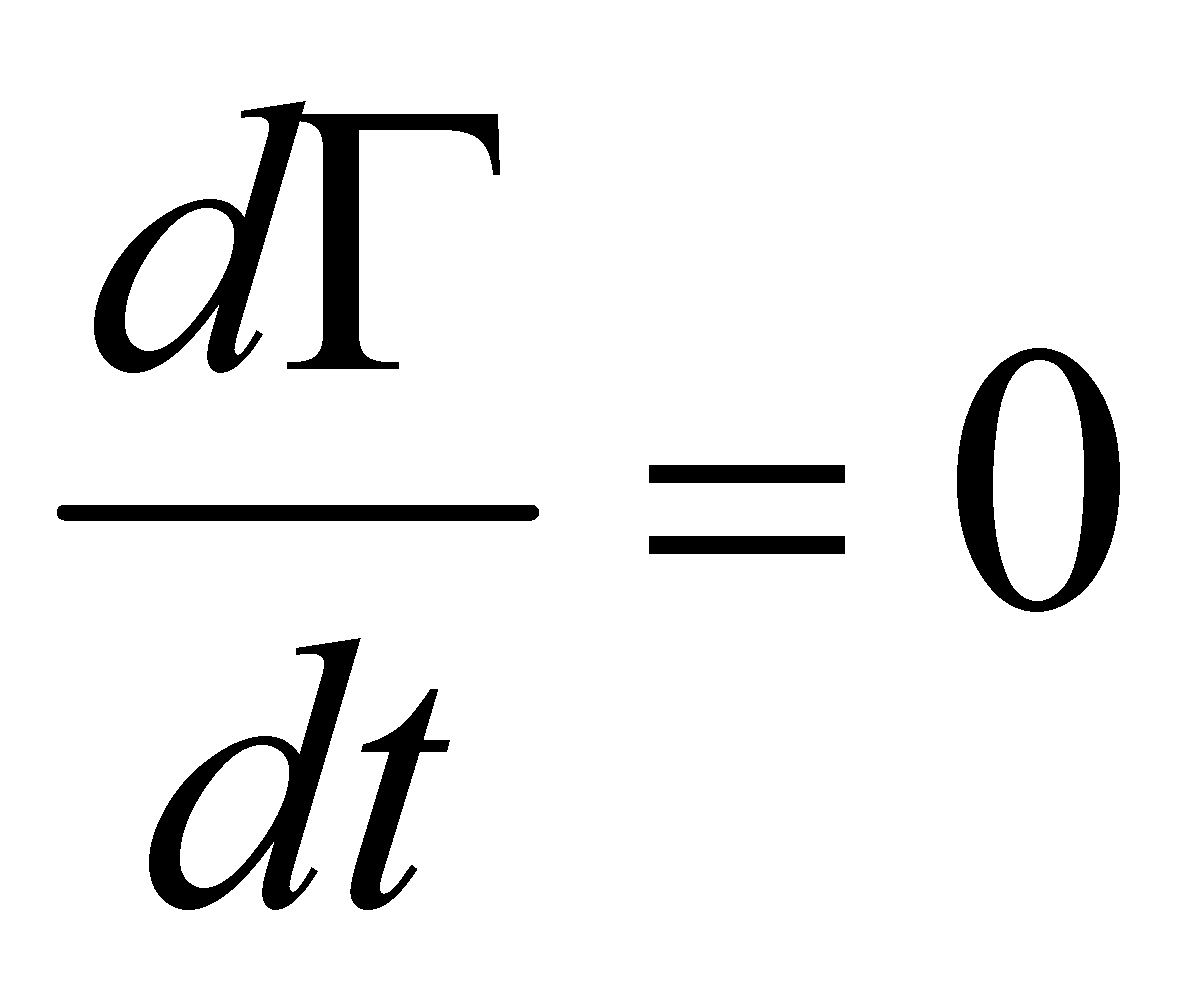
(последнее слагаемое в выражении производной обнуляется , т.к. )

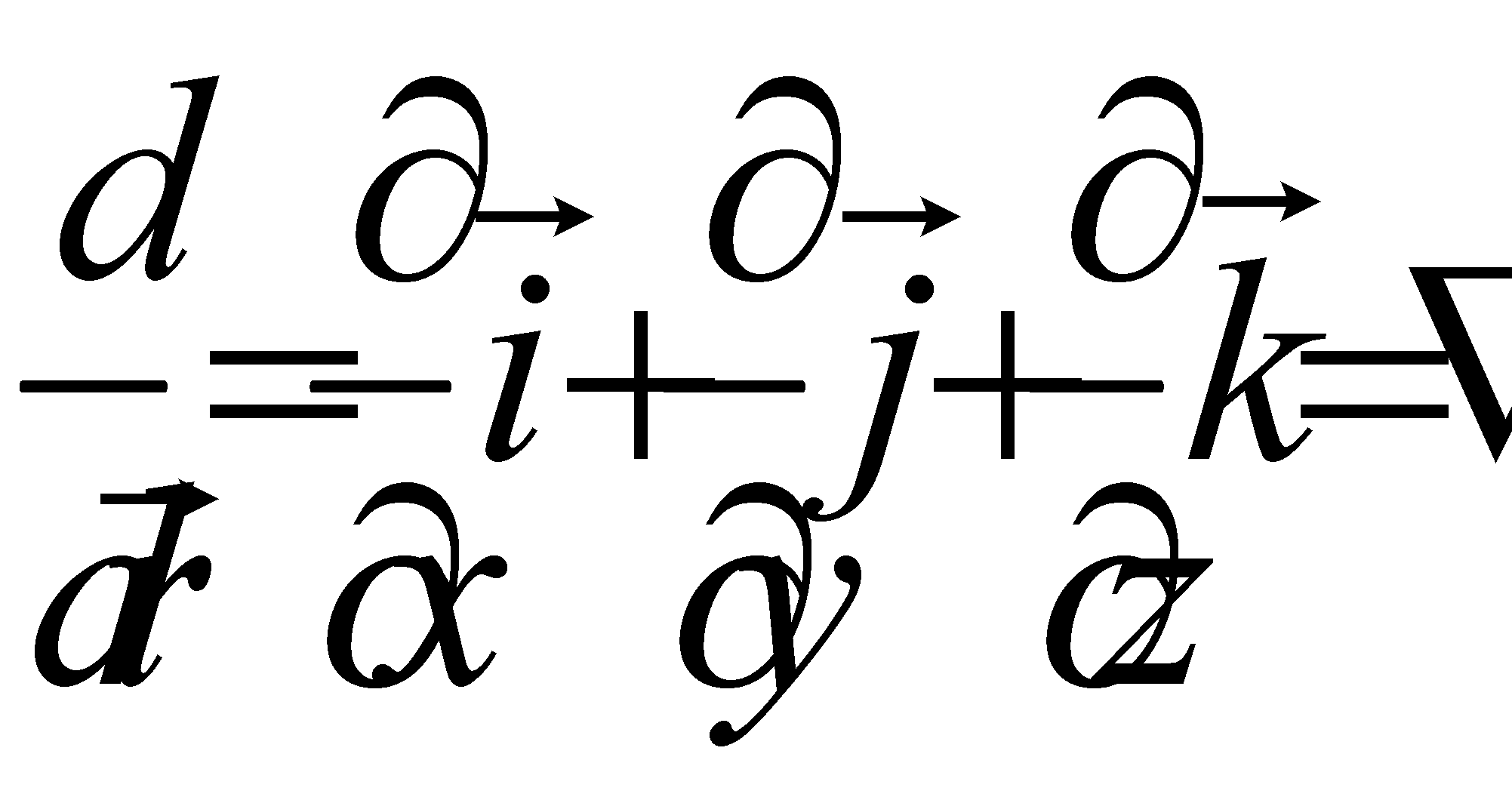
( оператор набла)
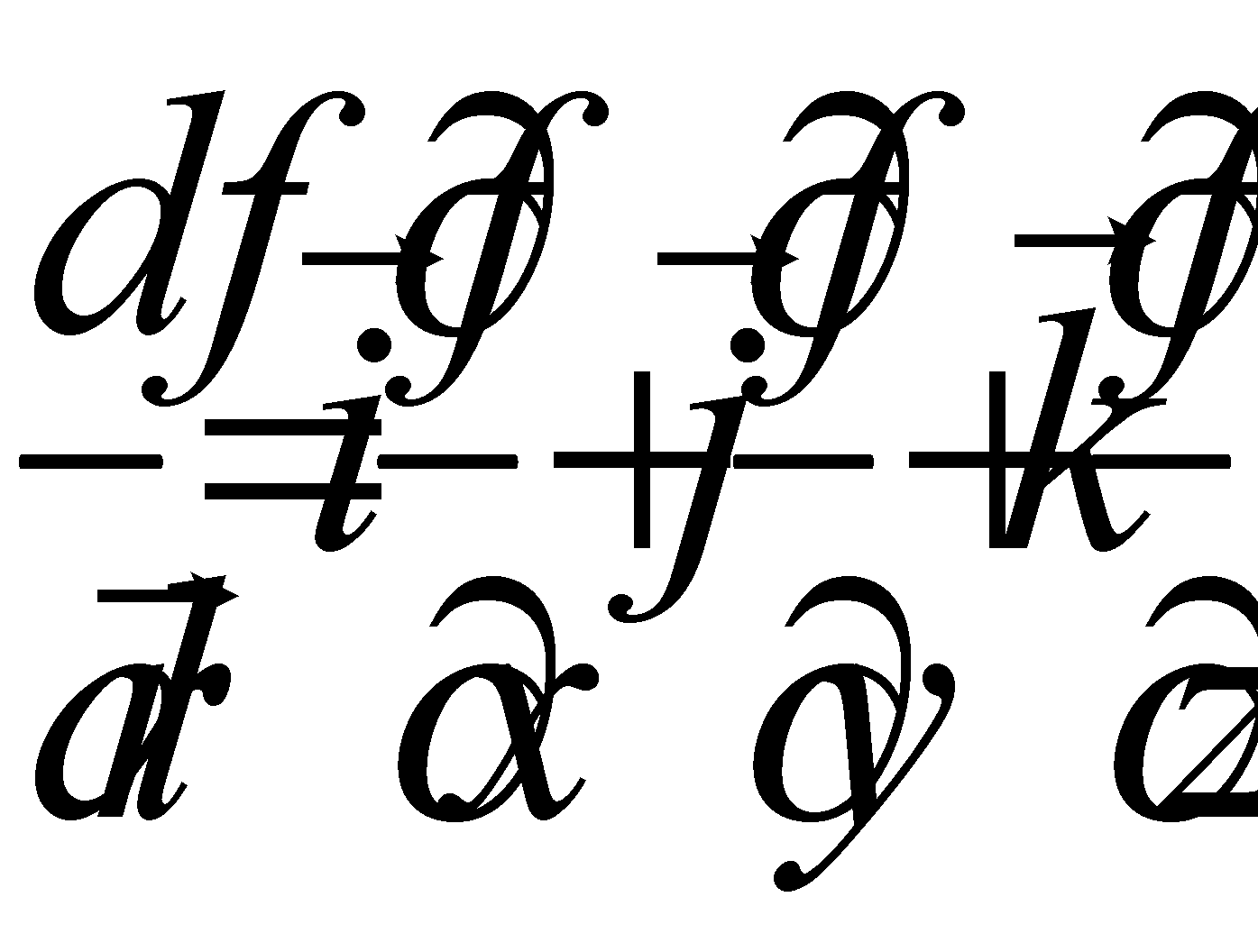
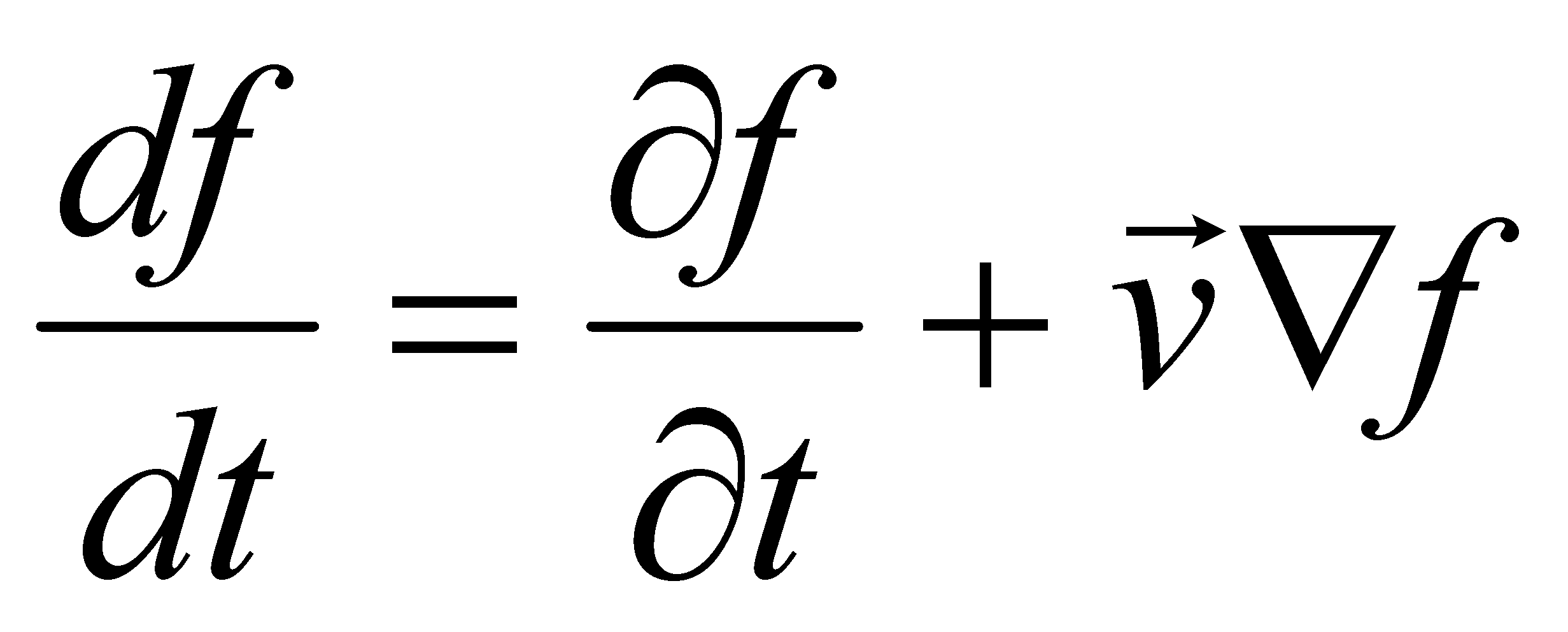
Выражение для производной примет вид : (6)
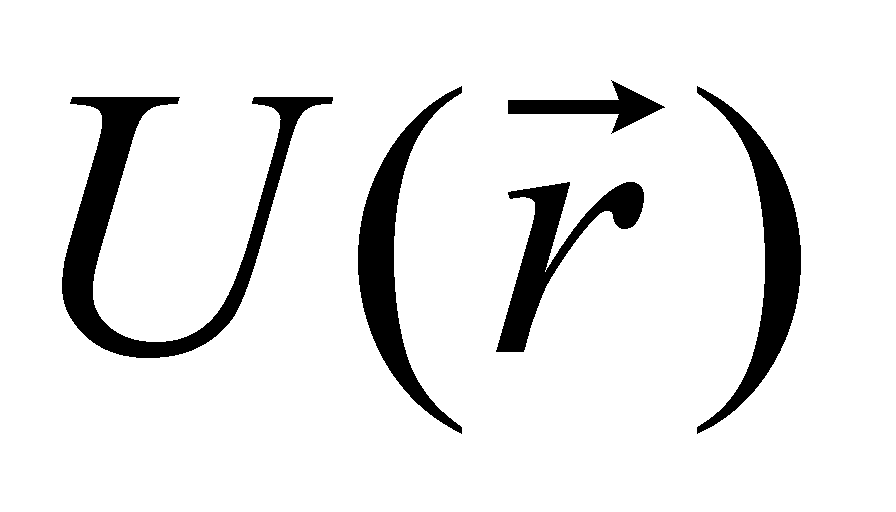
Пусть теперь газ находится во внешнем потенциальном поле , действующем на координаты центра тяжести молекул (например, в гравитационном поле). И пусть F – сила, действующая со стороны поля на частицу.
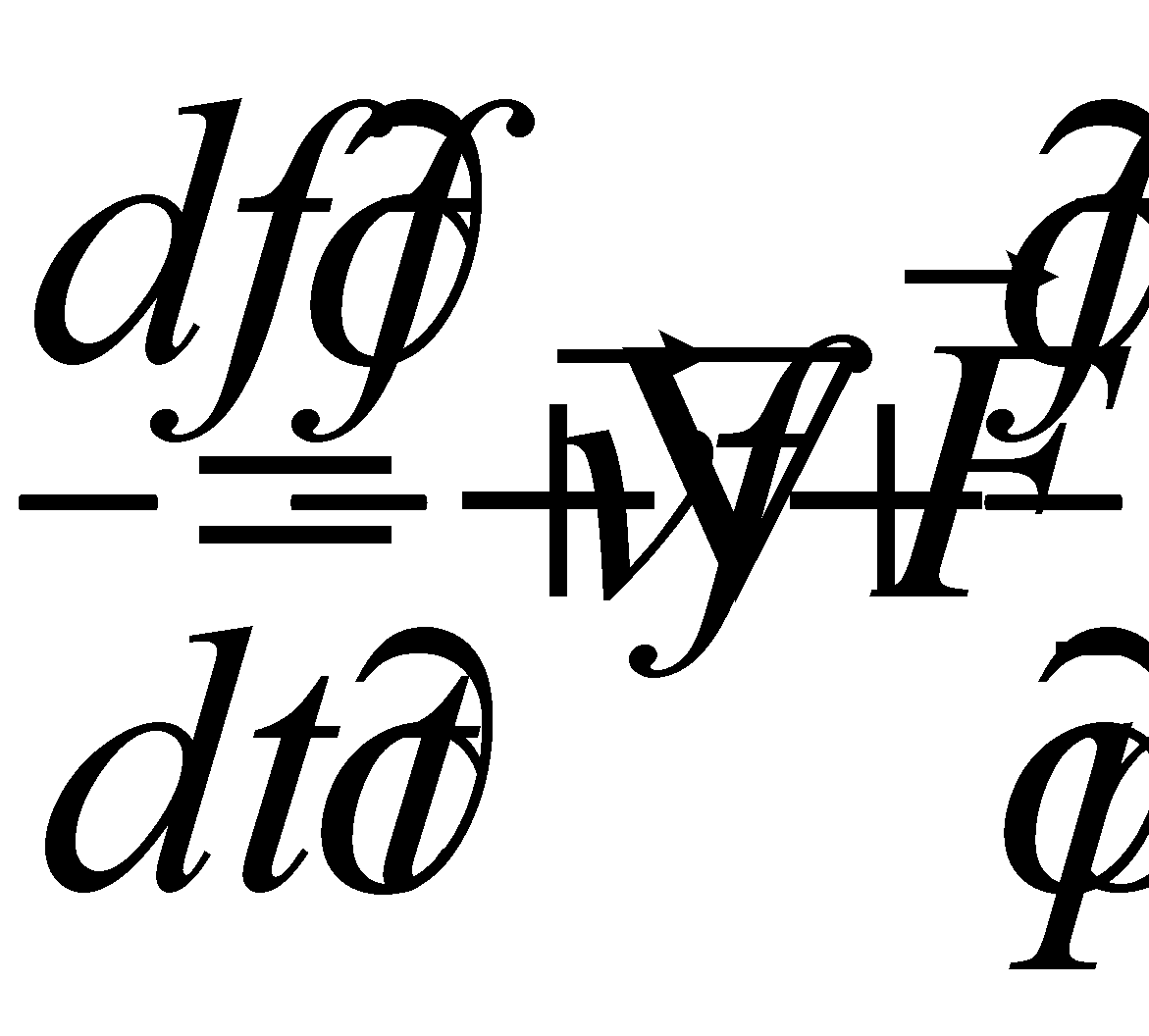
(7)
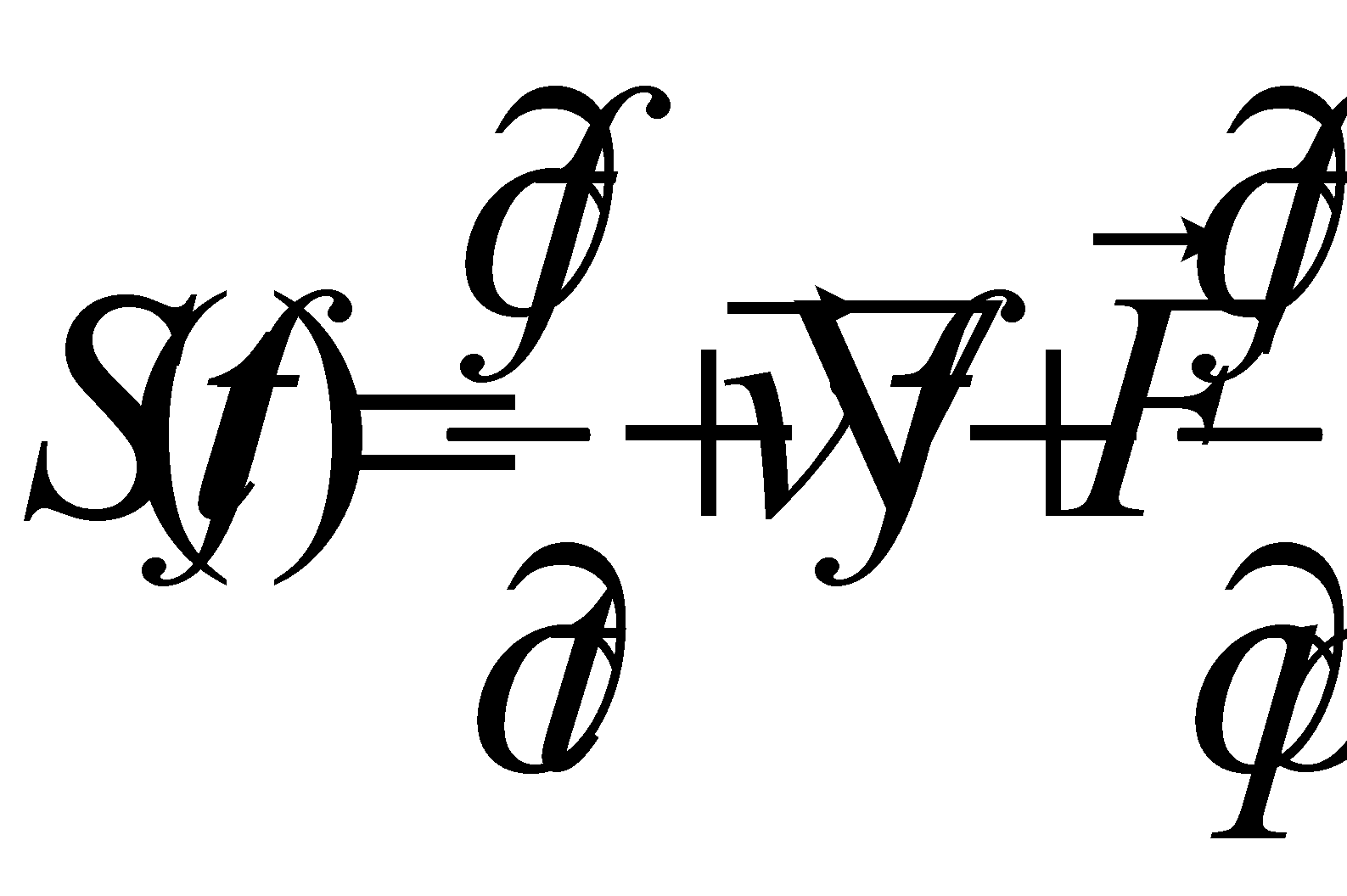
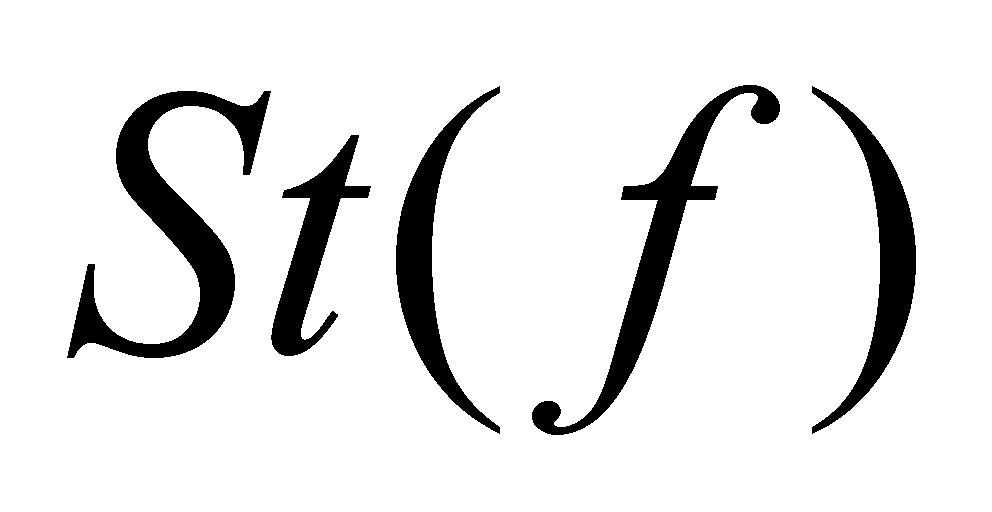
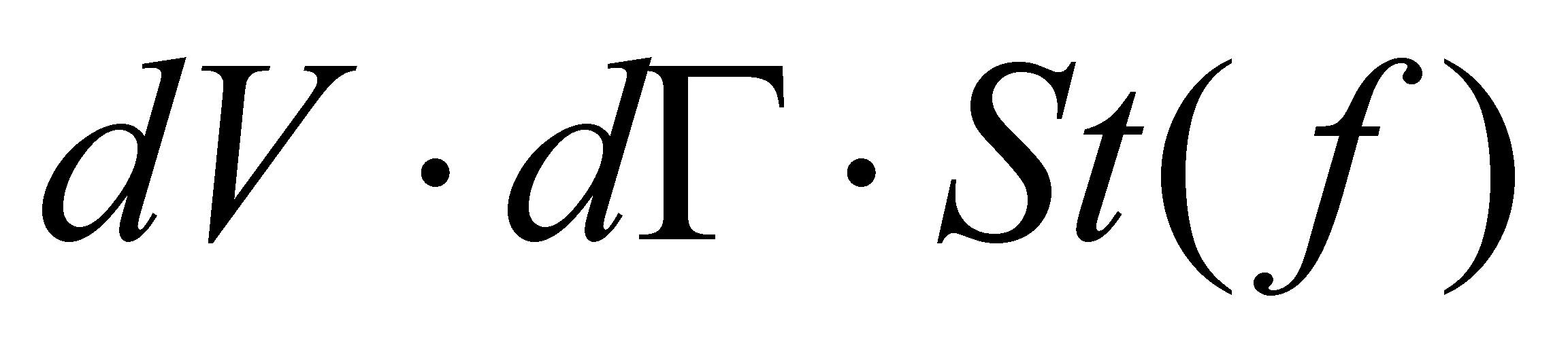
Правую часть равенства (6) обозначим через . Символ означает
скорость изменения функции распределения благодаря столкновениям, а величина
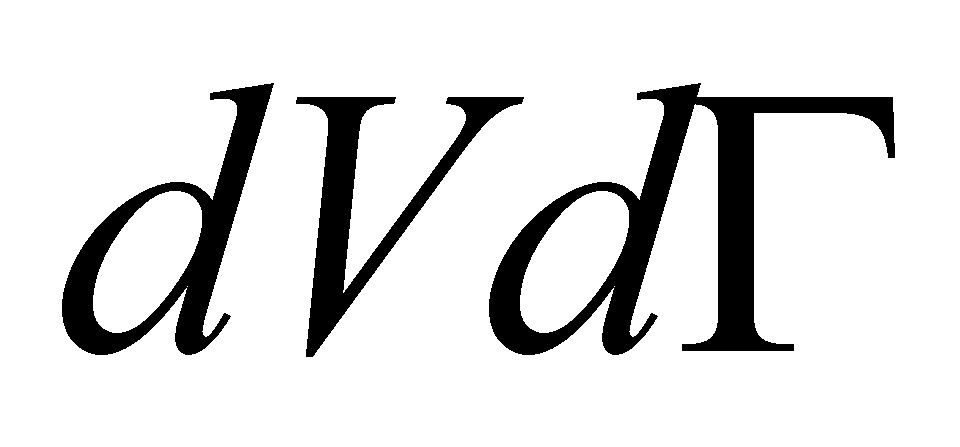
есть отнесённое к единице времени изменение за счёт столкновений числа молекул в фазовом объёме . Полное изменение функции распределения в заданной точке фазового пространства запишется в виде :
(8)
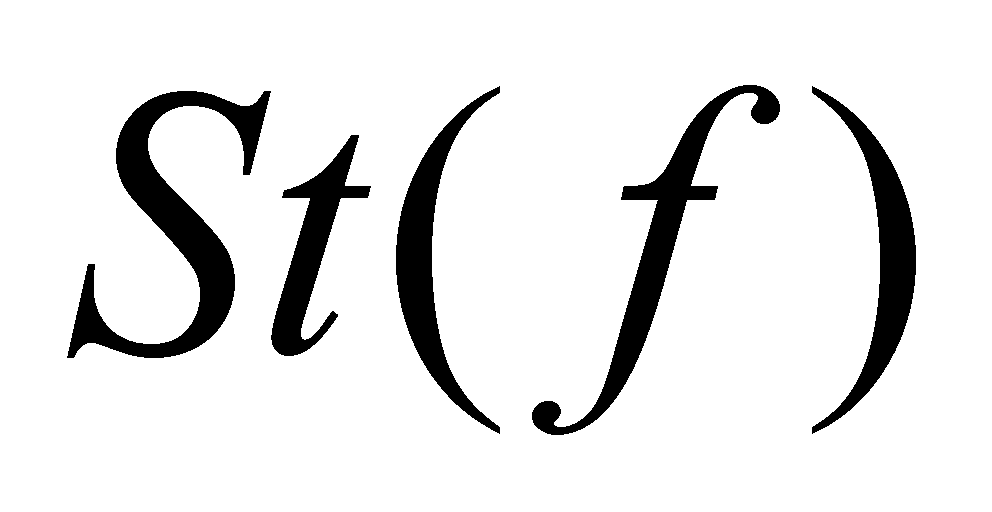
Величина называется интегралом столкновений, а уравнение вида (8) – кинетическим уравнением. Реальный смысл кинетическое уравнение (8) примет только после определения вида интеграла столкновений.
§
3 Определение вида интеграла столкновений и уравнения Больцмана.
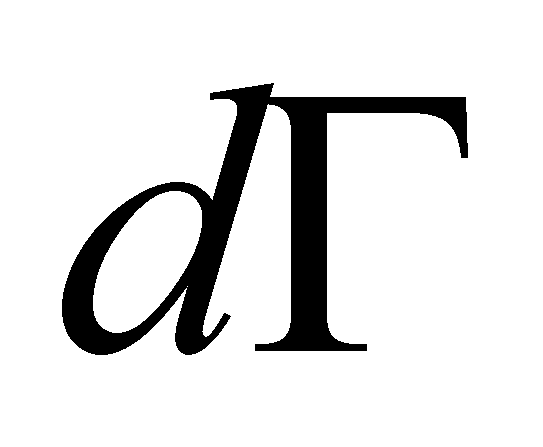
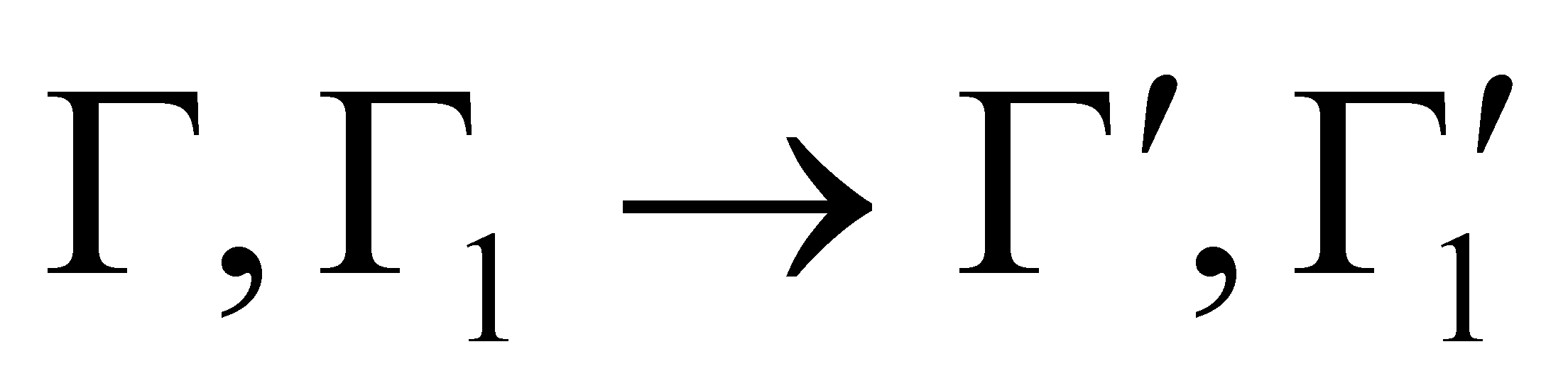
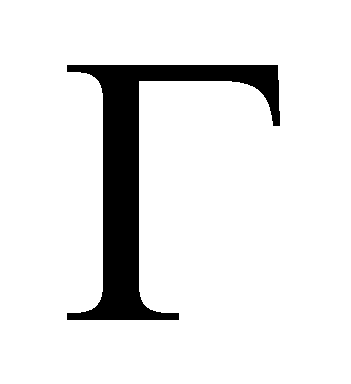
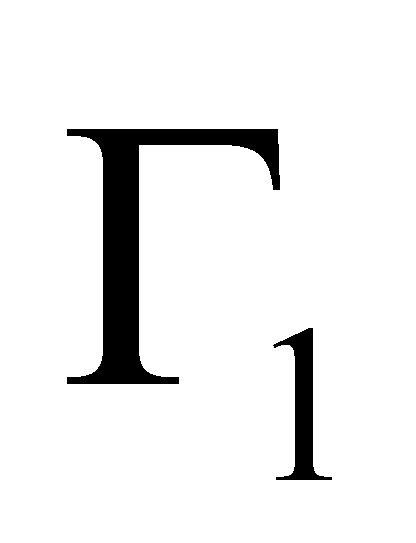
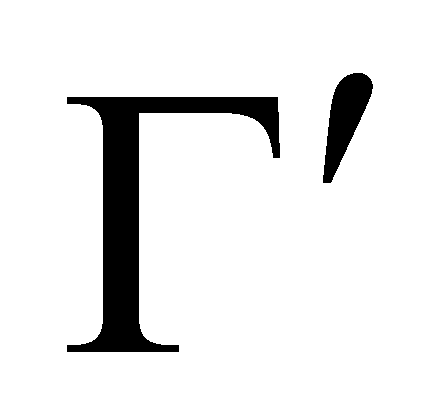
Во время столкновения молекул происходит изменение величин, от которых зависит функция распределения. Учитывая тот факт, что время наблюдения состояния системы и координаты частиц изменяются, не зависимо от того, произошло или нет столкновение частиц (которое влияет лишь на характер изменения координат),можно утверждать,что изменяются величины Г столкнувшихся молекул. Рассматривая достаточно малый интервал, обнаружим, что молекулы при столкновении выводятся из этого интервала, т.е. имеют место акты “ухода”. Пусть двум столкнувшимся молекулам соответствуют, как и ранее, величины и до столкновения ,а , после столкновения (для краткости говорим о переходе ).
Полное число столкновений при вышеуказанном переходе со всеми возможными значениями
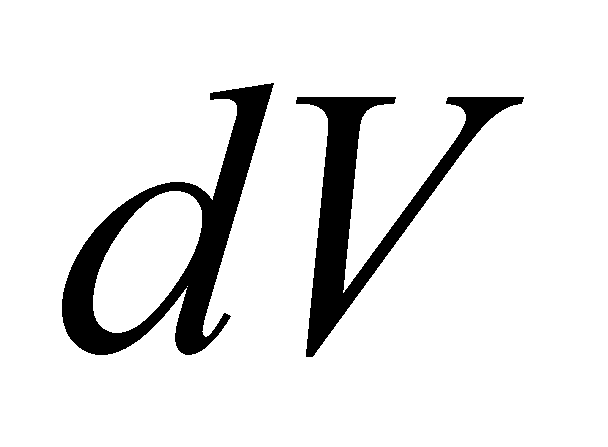
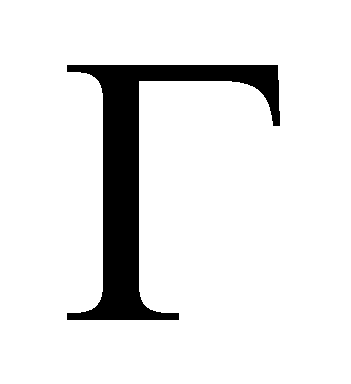
при заданном , происходящих в единицу времени в объёме ,определяется интегралом
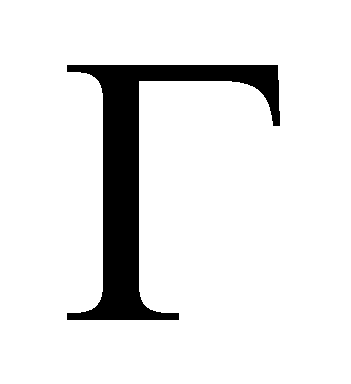
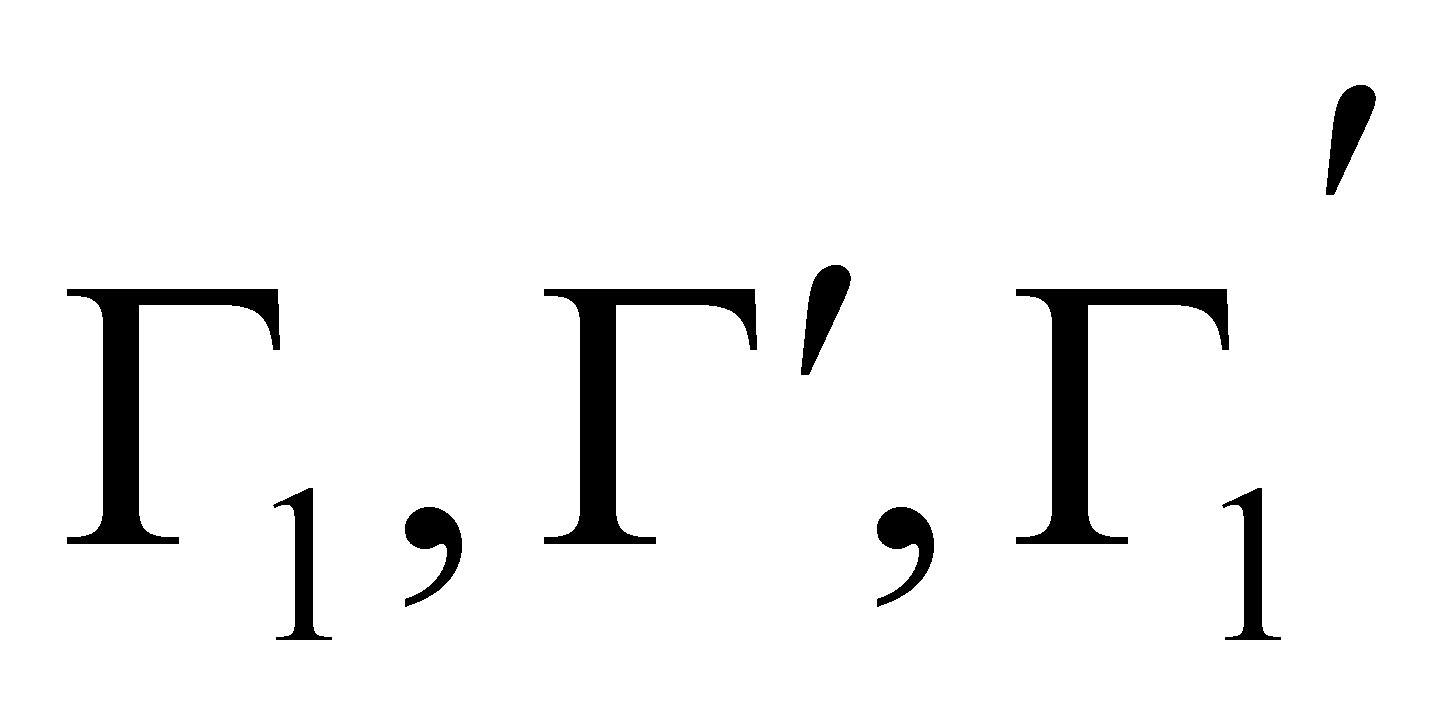
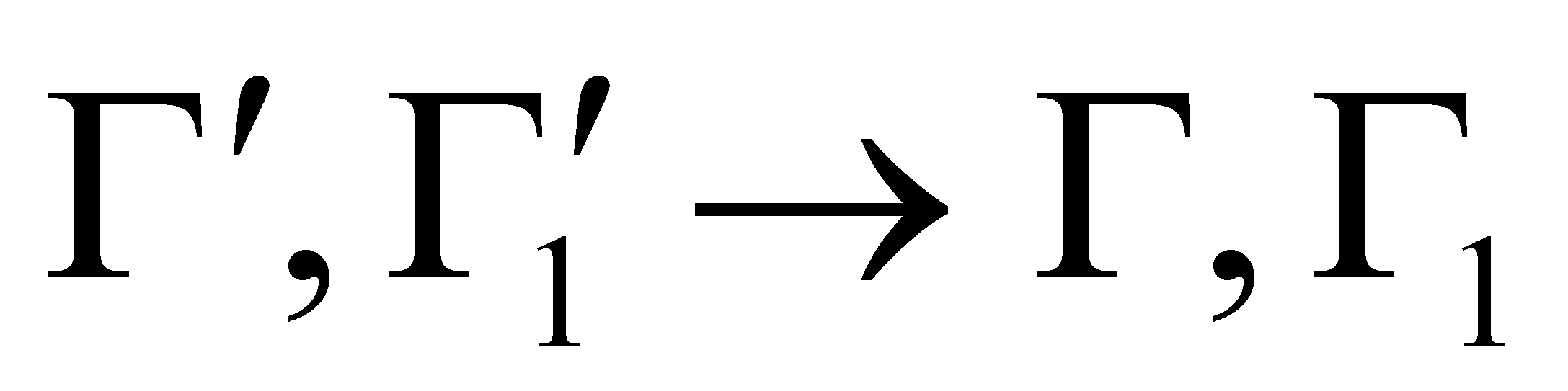
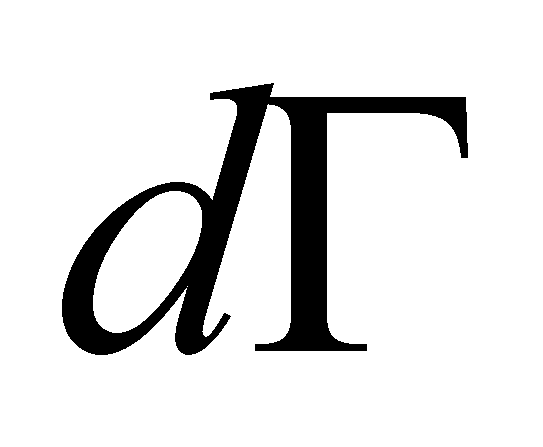
В то же время происходят столкновения иного рода (называемые “приходом”), в результате которых молекулы, обладавшие до столкновения значениями величин , лежащими вне заданного интервала , попадают в этот интервал. Такие переходы могут быть обозначены следующим образом: (со всеми возможными значениями при заданном ). Аналогично первому типу перехода полное число таких столкновений в единицу времени в объёме равно:
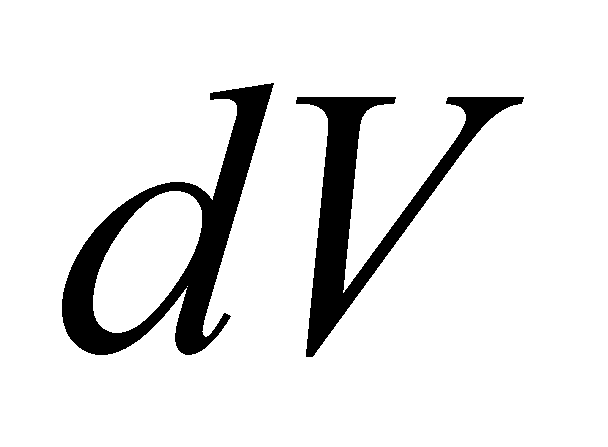
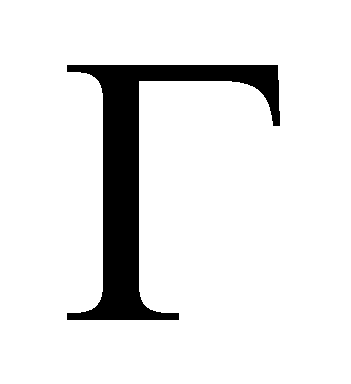
В результате всех столкновений изменение числа молекул в единицу времени в элементарном объёме определяется разностью между числом актов ухода и числом актов прихода:
(9) , где
и
Интеграл столкновений может быть определён как:
(10)
(изменение числа частиц в единицу времени в фазовом объёме dVdГ )

Из соотношений (8) и (9) получим вид интеграла столкновений
(11)
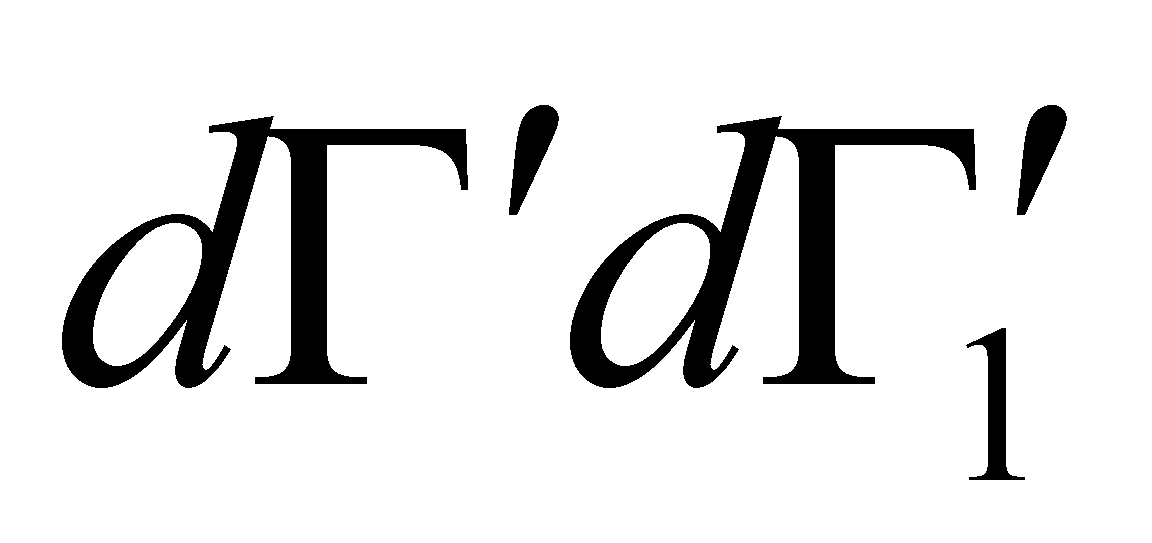
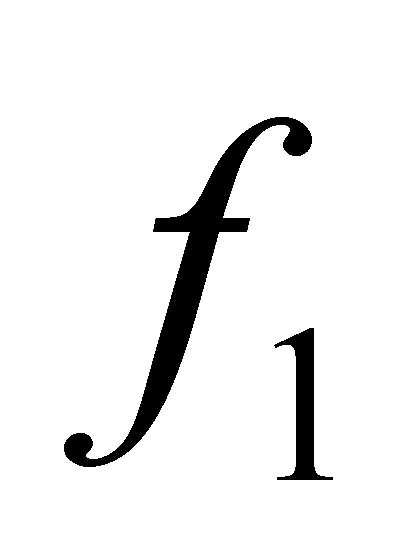
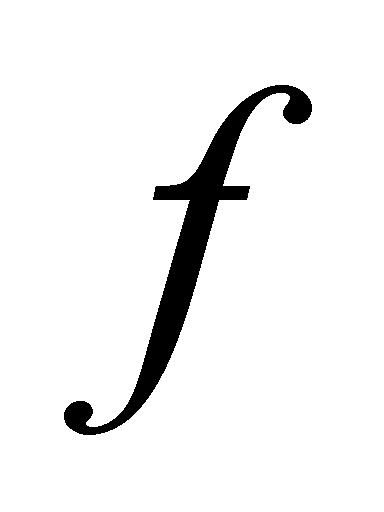
Заметим, что во втором члене подынтегрального выражения интегрирование по имеет
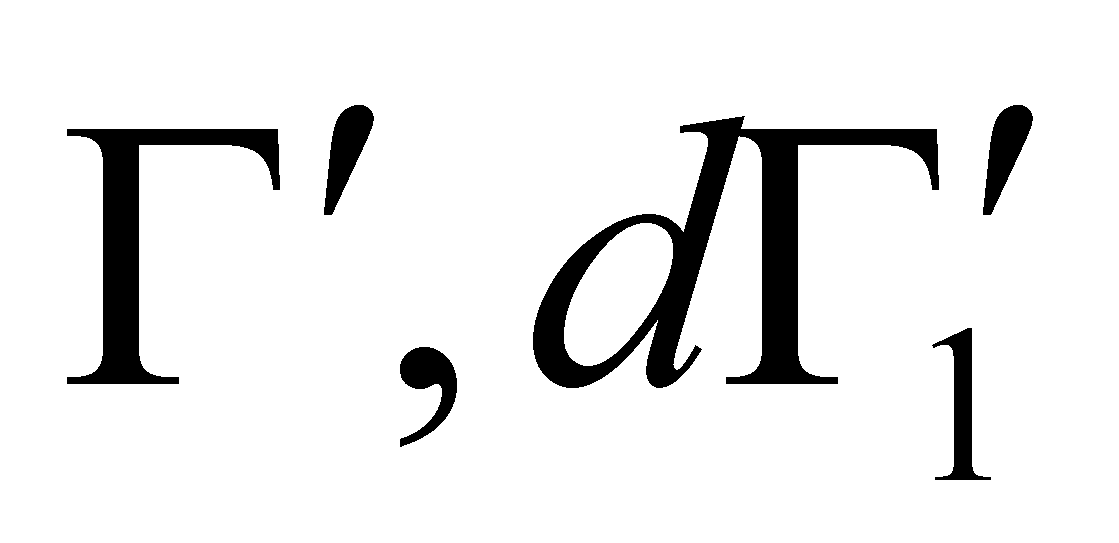
отношение только к функции . Множители и не зависят от переменных . Преобразовав эту часть интеграла с помощью соотношения (4) , получим окончательный вид интеграла столкновений
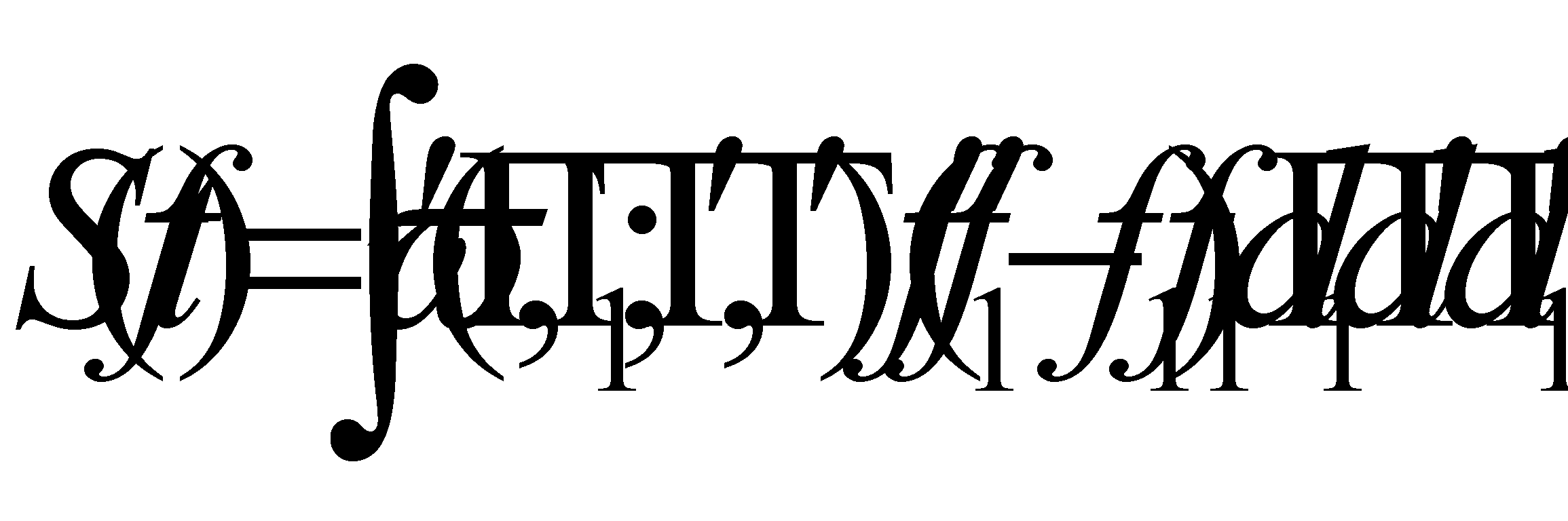
(12)
и кинетического уравнения
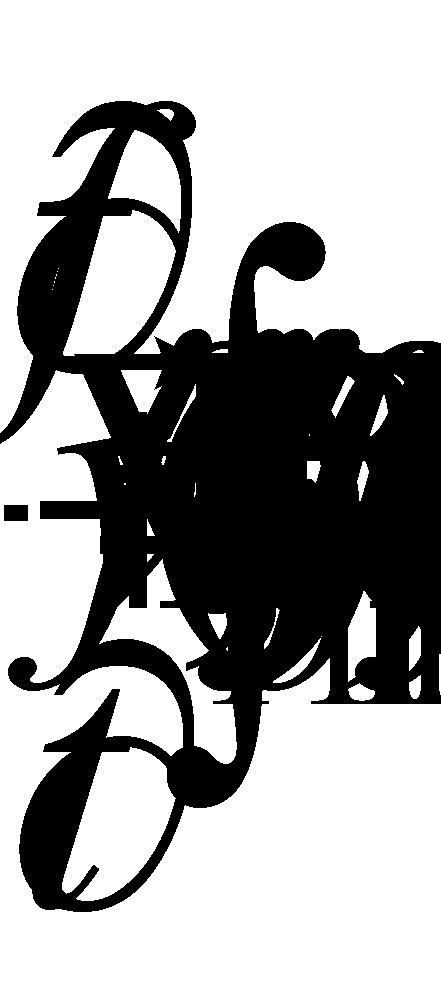
(13)
Полученное интегрально - дифференциальное уравнение носит название уравнения Больцмана.
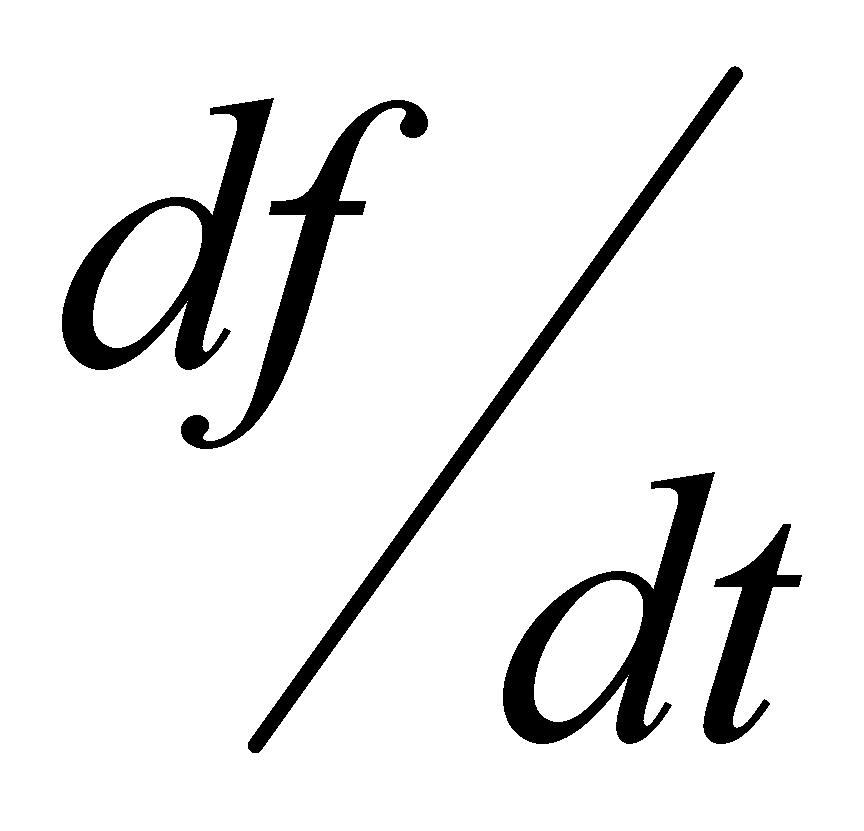
Рассмотрим не зависящее от времени распределение в состоянии равновесия системы в отсутствии внешних воздействий. Такое распределение является стационарным (не зависит от времени) и однородным (не изменяется в области пространства, занимаемой системой). Наложенные условия обнуляют производную функции распределения по времени и трём координатам; левая часть кинетического уравнения обращается в нуль. Подынтегральное выражение обращается в нуль вследствие равенства (3). Следовательно, равновесное распределение в отсутствии внешних полей удовлетворяет кинетическому уравнению тождественным образом. Если газ находится в равновесном состоянии под действием внешнего потенциального (например, гравитационного) поля, то функция распределения и в этом случае удовлетворяет кинетическому уравнению. Действительно, равновесное распределение выражается через интеграл движения – полную энергию молекулы . Левая часть кинетического уравнения представляет собой полную производную , которая равна нулю как производная от функции, зависящей только от интегралов движения. Правая часть уравнения, как уже было указано, есть нуль. Таким образом, кинетическому уравнению удовлетворяет и функция распределения газа, находящегося в равновесии во внешнем потенциальном поле.
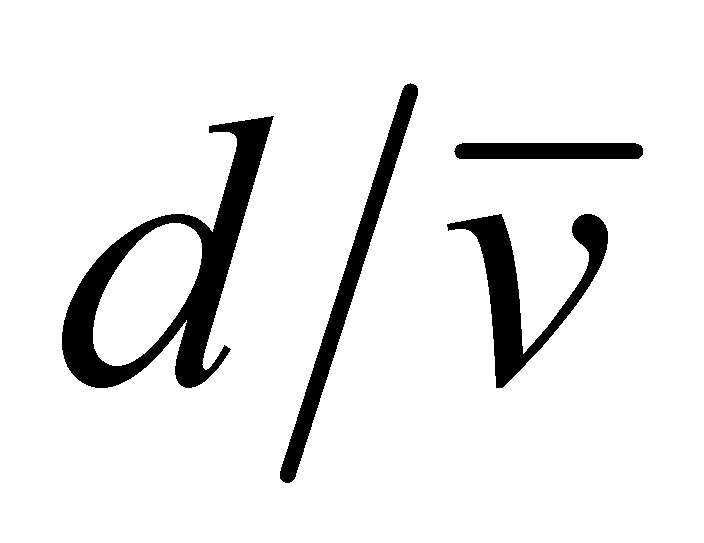
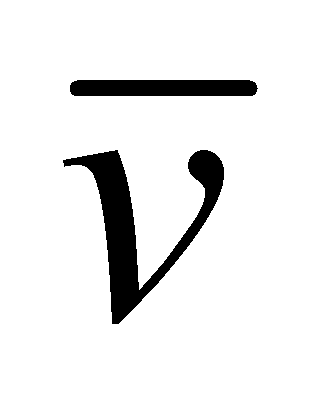
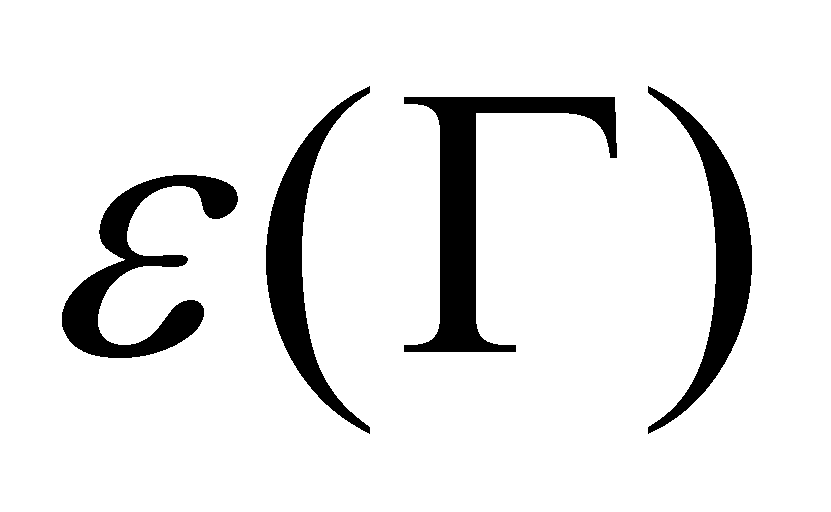
К указанным во “Введении” допущениям добавим ещё одно: столкновения молекул рассматриваются как мгновенные акты, происходящие в одной “точке” пространства. Кинетическое уравнение описывает процес, который протекает в интервале времени, много большем по сравнению с длительностью столкновений. В то же время, рассматриваемая область системы должна значительно превышать область столкновения частиц, которая имеет размеры порядка величины радиуса действия молекулярных сил d. Время столкновения по порядку величины может быть определено как ( - средняя скорость движения молекул в газе). Полученные значения представляют собой нижний предел расстояния и времени, при рассмотрении которых допускается применение кинетического уравнения. Реальные физические задачи не требуют столь детального описания процесса; размеры системы и время наблюдения значительно превышают требуемый минимум.
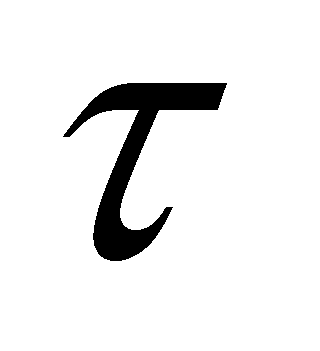
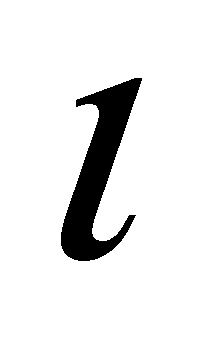
Для качественного рассмотрения кинетических явлений, протекающих в газе, используют грубые оценки интеграла столкновений через два параметра: длины свободного пробега и времени свободного пробега . Пусть при движении молекула прошла единицу длины, столкнувшись при этом с молекулами, находящимися в объеме прямого цилиндра единичной длины и площадью основания ( - эффективное сечение молекулы). В этом объёме имеется молекул.
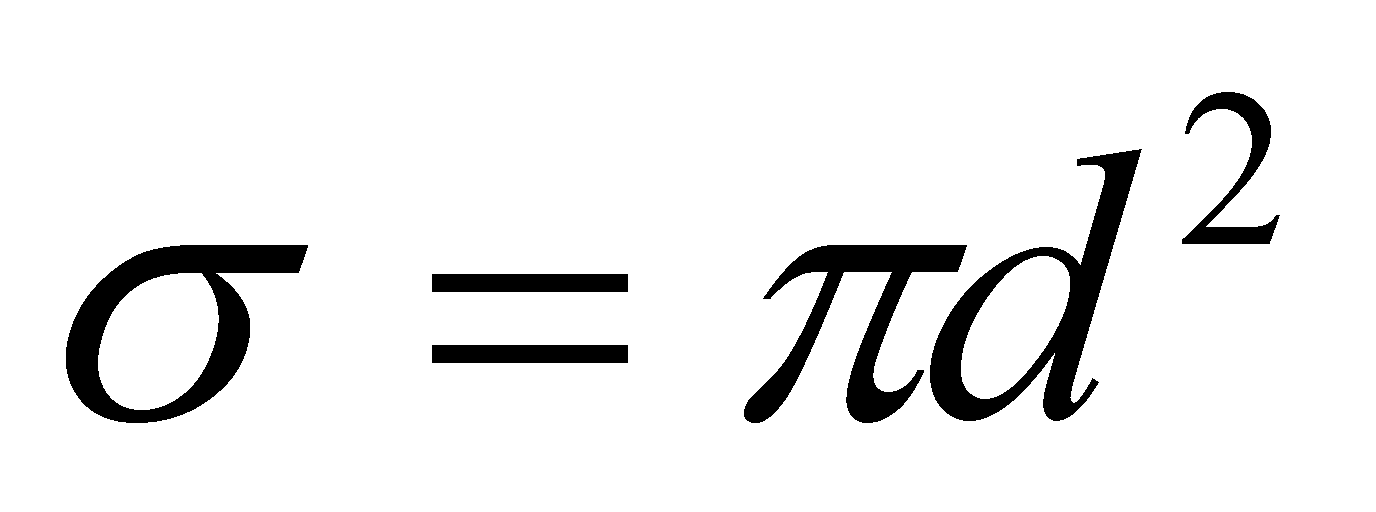
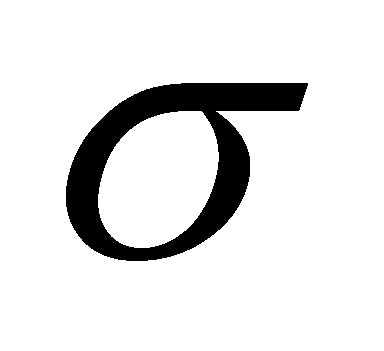
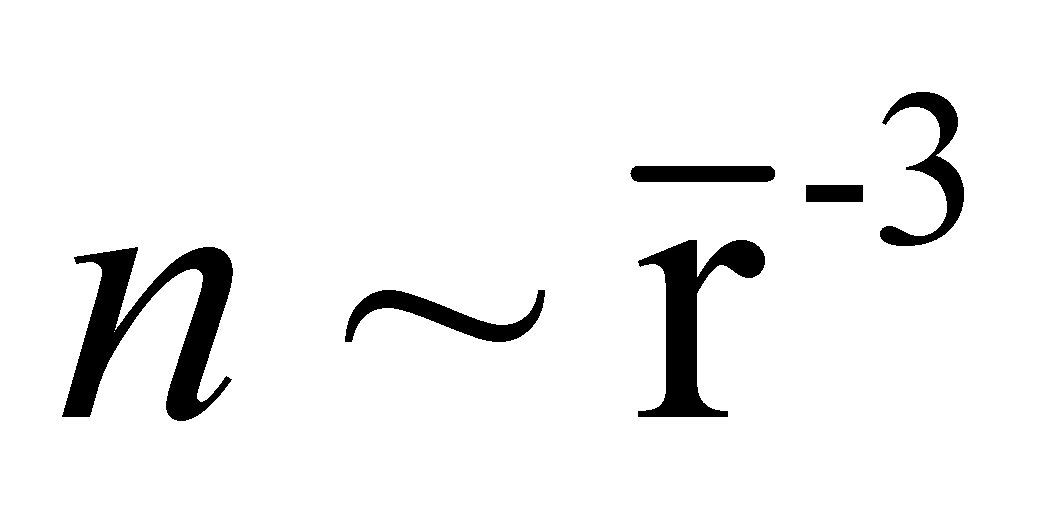
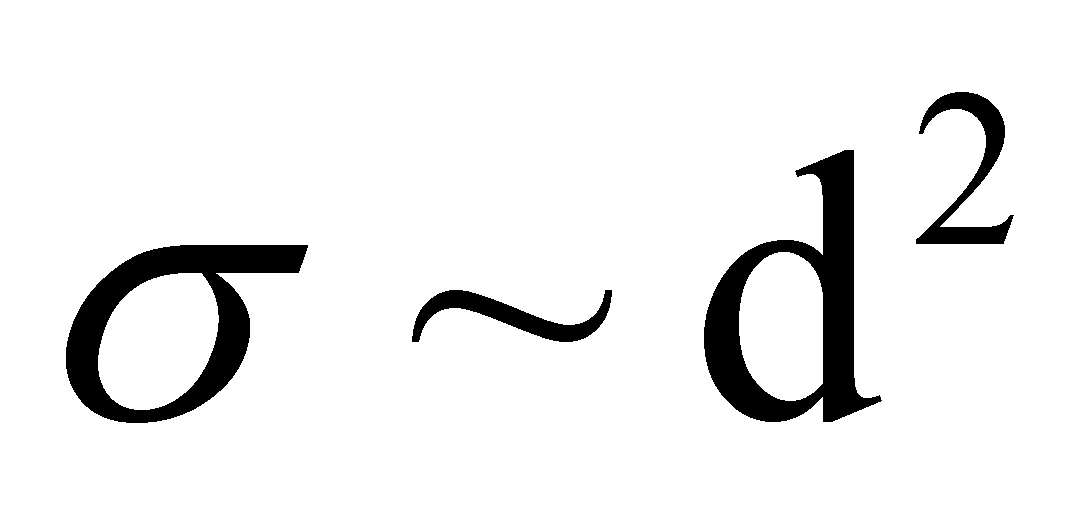
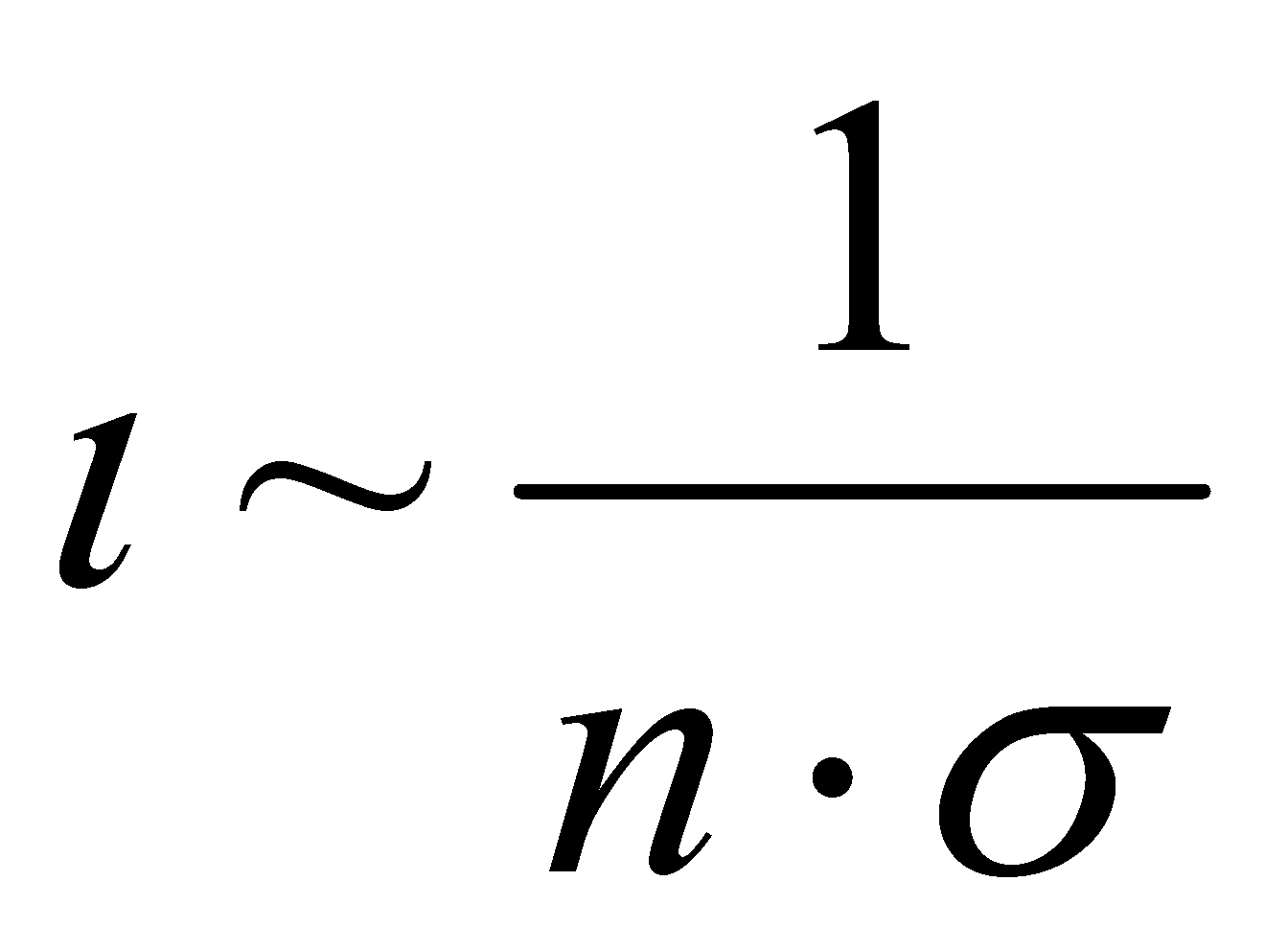
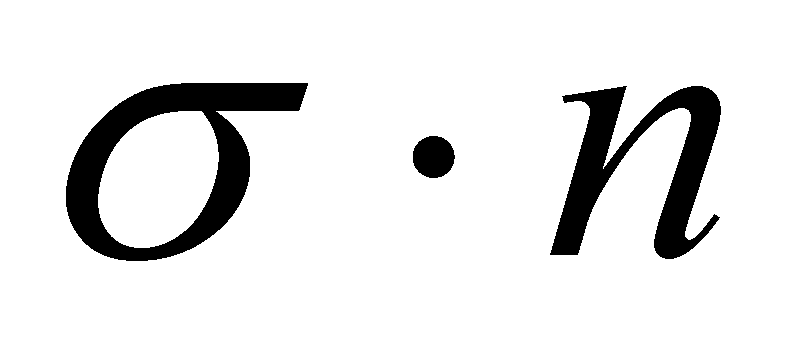
-
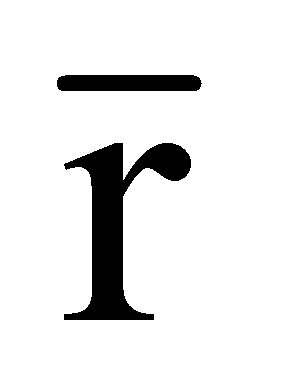
среднее расстояние между молекулами;
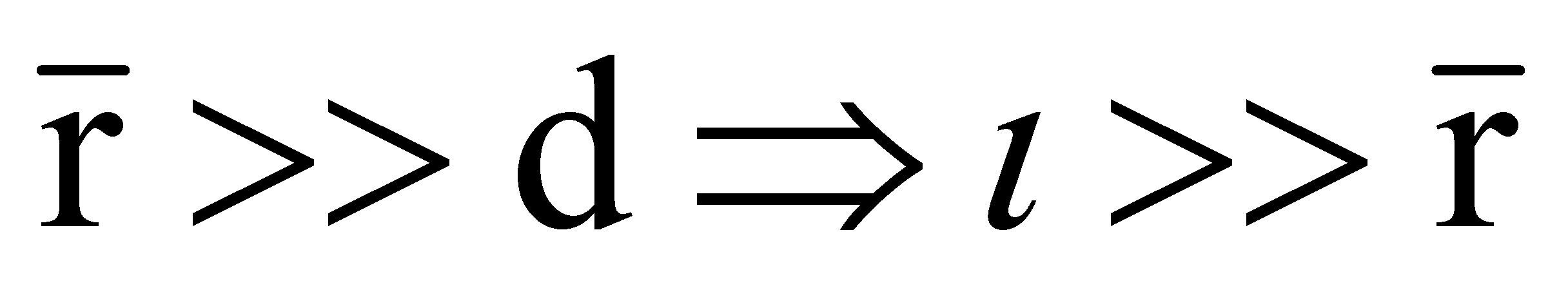
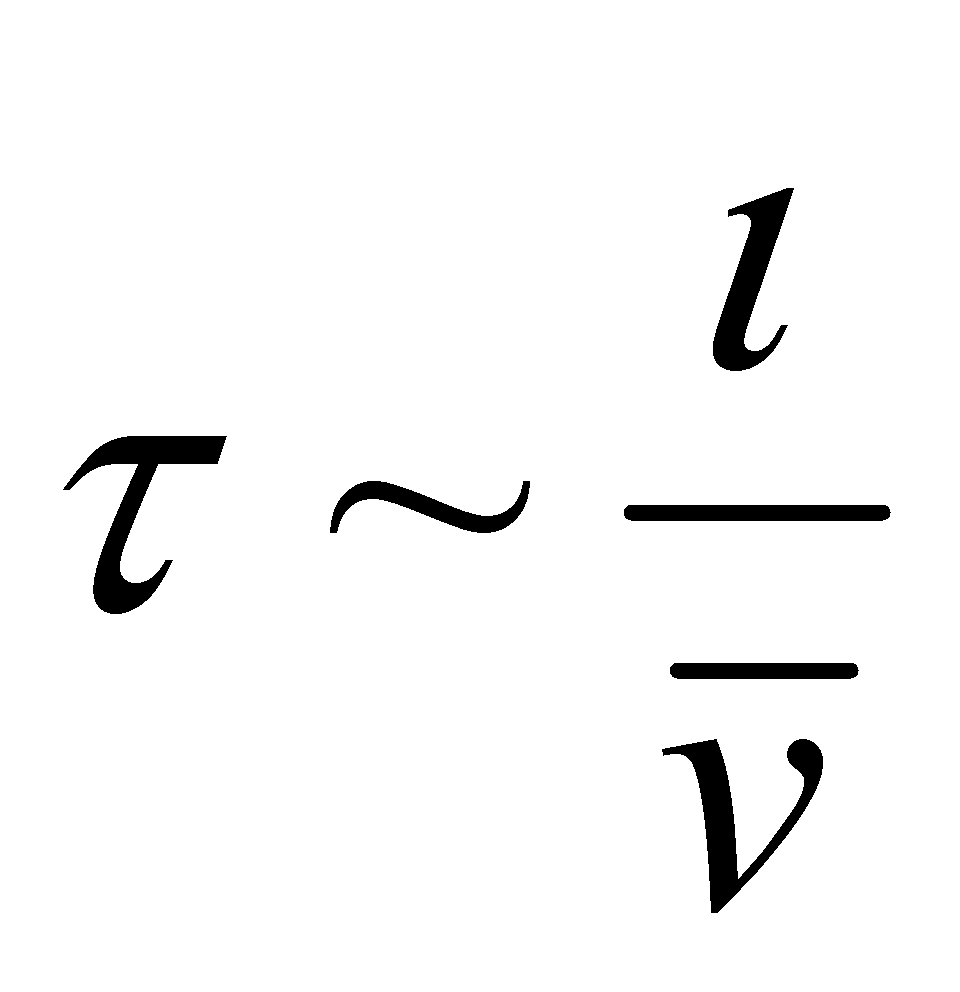
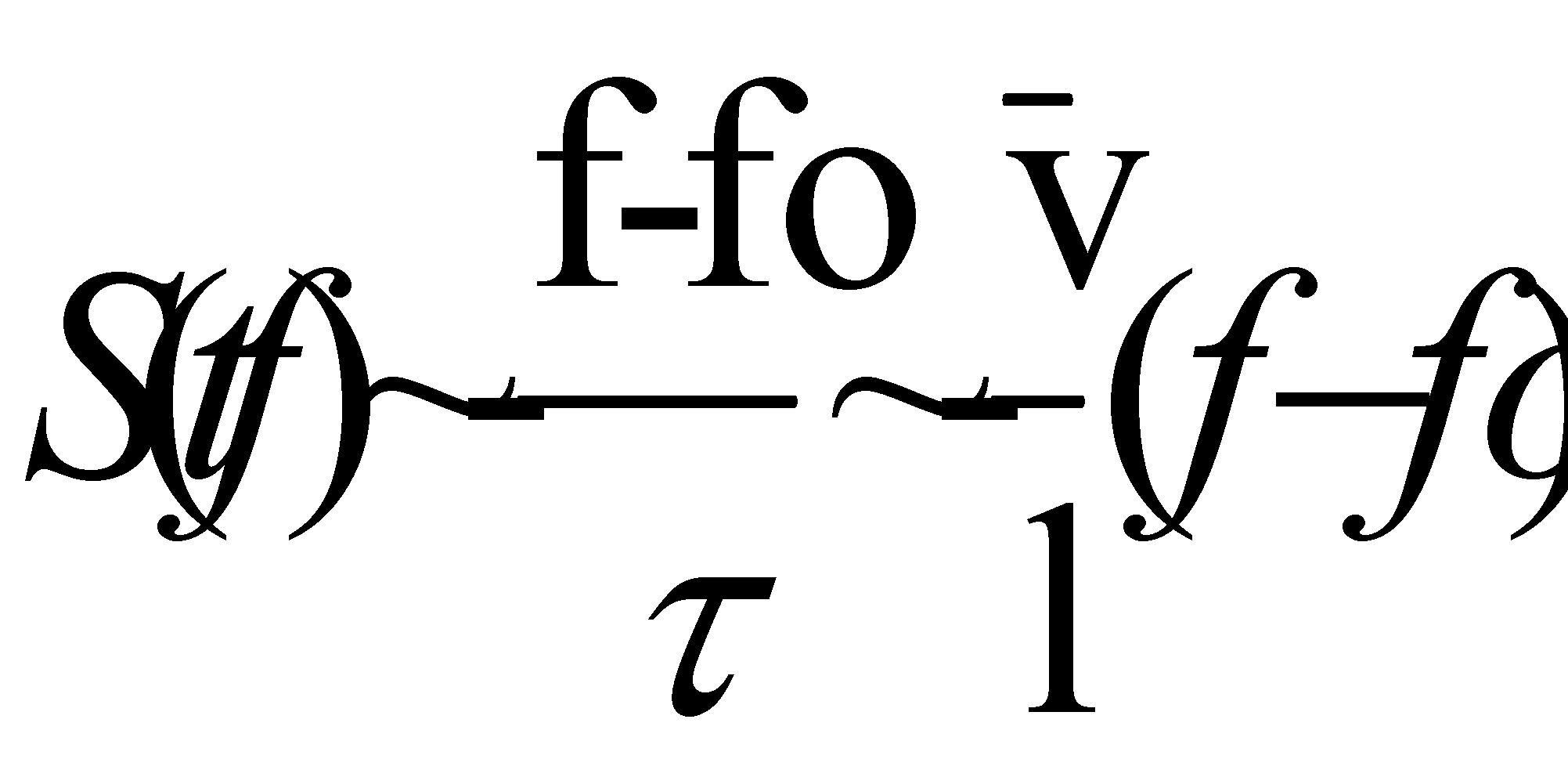
Величина - время свободного пробега. Для грубой оценки интеграла столкновений можно использовать:
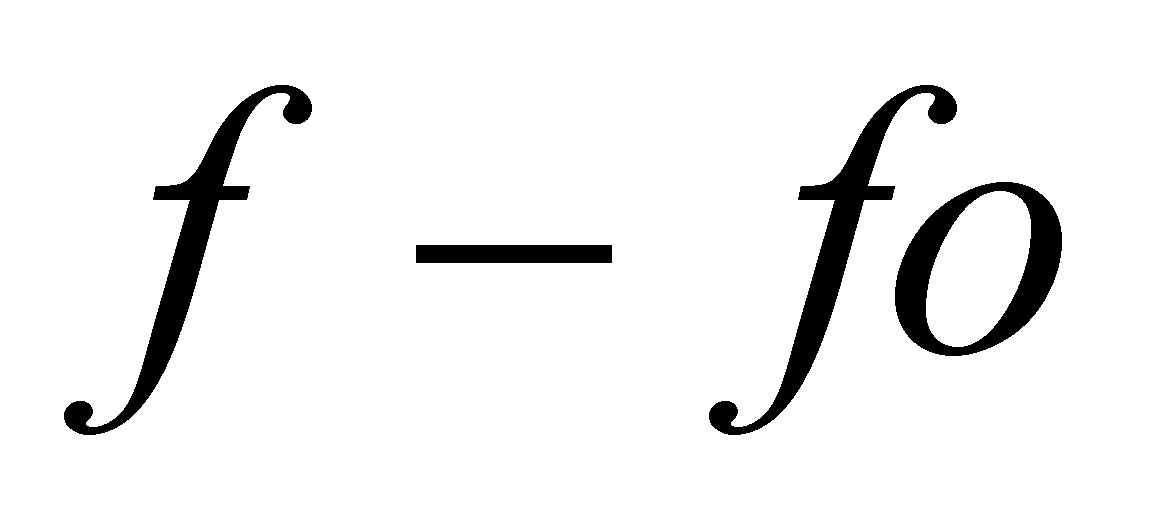
Записанная в числителе разность учитывает тот факт, что интеграл столкновений обращаются в нуль для равновесной функции распределения, а знак “минус” говорит о том, что столкновения являются механизмом установления статистического равновесия, т.е. стремятся уменьшить отклонение функции распределения от равновесной ( иными словами, любая система, выведенная из состояния равновесия, отвечающего минимальной внутренней энергии системы, и предоставленная самой себе, стремится вернуться в равновесное состояние).
§
3 Переход к макроскопическим уравнениям. Гидродинамическое уравнение непрерывности.
Кинетическое уравнение Больцмана даёт микроскопическое описание эволюции состояния газа. Но на практике часто не требуется столь детально описывать процессы, поэтому при рассмотрении задач гидродинамики, задач о протекании процессов в неоднородных или сильно разреженных газах, задач о теплопроводности и диффузии газов и ряда других имеет смысл переходить к менее детальным (а следовательно более простым ) макроскопическим уравнениям. Такое описание применимо к газу, если его макроскопические свойства (температура, плотность, концентрация частиц, давление и т.п.) достаточно медленно меняются вдоль любого, произвольно выбранного направления в газе. Расстояния, на которых происходит существенное изменение макрокскопических параметров, должны значительно превышать длину свободного пробега молекул.
В качестве примера рассмотрим рассмотрим способ получения гидродинамического уравнения.
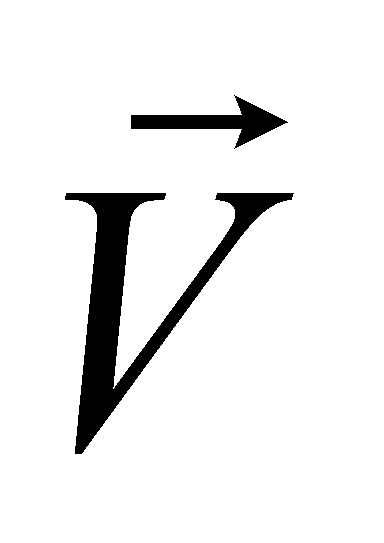
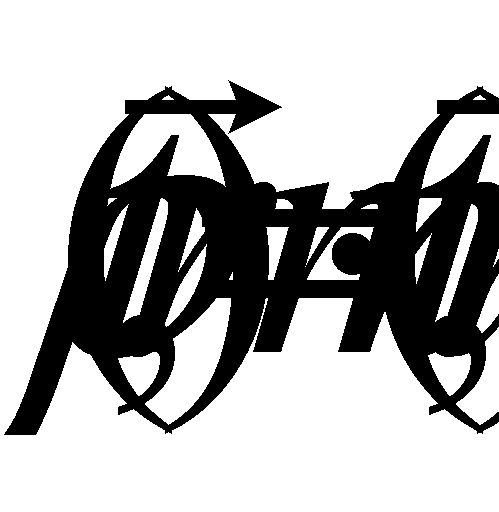
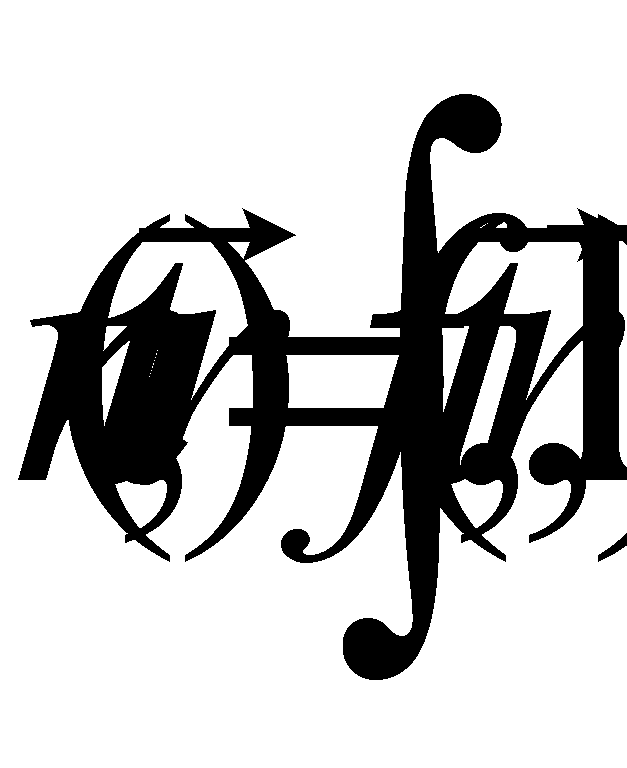
Выражение определяет плотность распределения молекул газа в пространстве (концентрацию молекул газа). Произведение массы одной молекулы (предполагается, что газ состоит из одинаковых частиц) на плотность распределения молекул даёт массовую плотность газа: . Обозначим через макроскопическую скорость движения газа как целого, а через микроскопическую скорость молекул. Макроскопическая скорость (скорость движения центра масс) может быть определена как средняя величина от микроскопических скоростей молекул

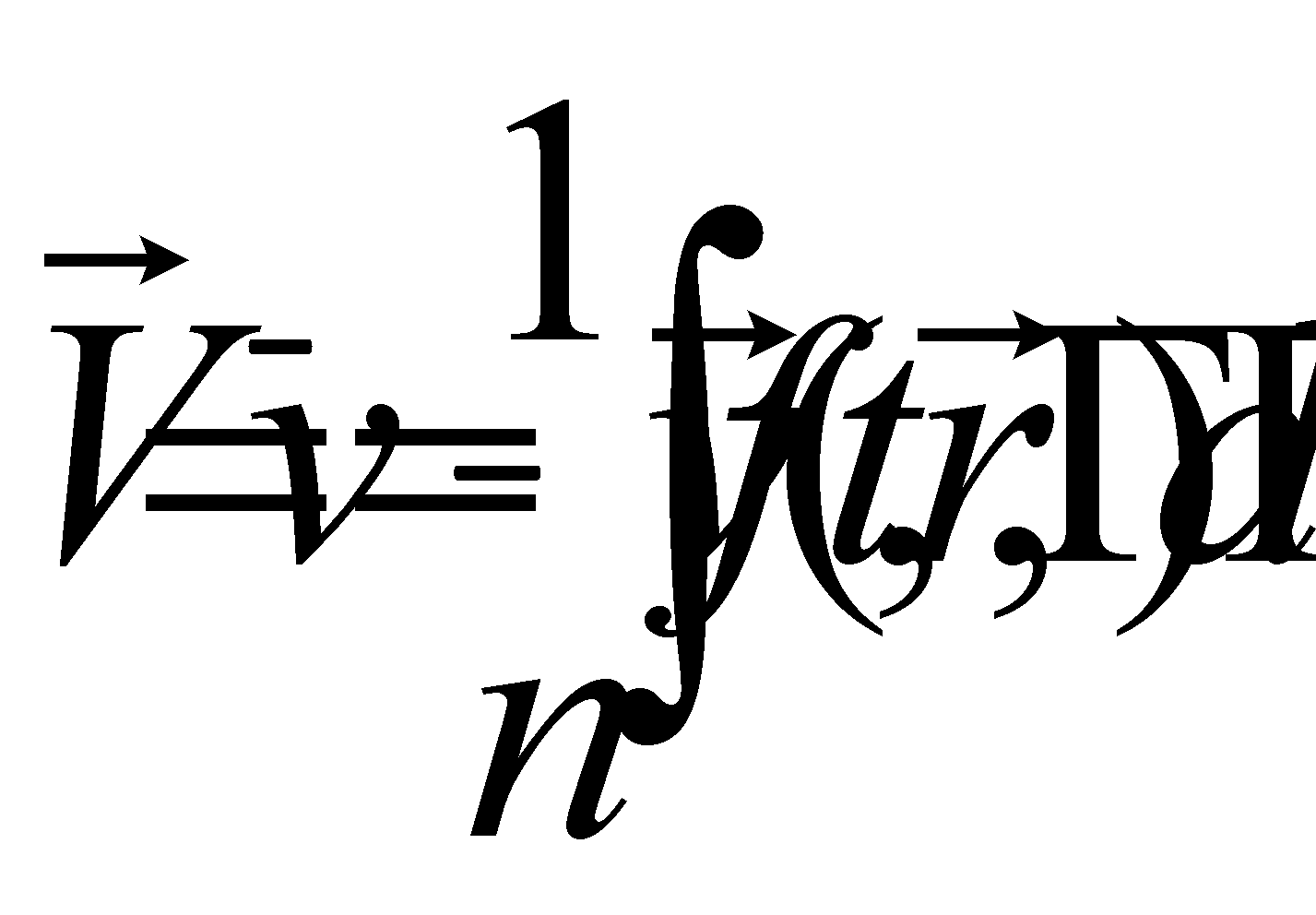
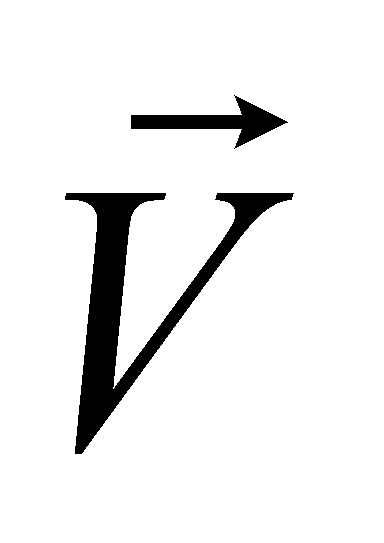
Столкновения не изменяют ни количества сталкивающихся частиц ни их суммарной энергии или импульса (столкновение молекул считается абсолютно упругим ударом). Столкновительная часть изменения функции распределения не может привести к изменению плотности, внутренней энергии, скорости и любых других макроскопических параметров газа в каждом его элементе объёма. Действительно, столкновительная часть изменения полного числа молекул в единице объёма газа даётся равным нулю интегралом:
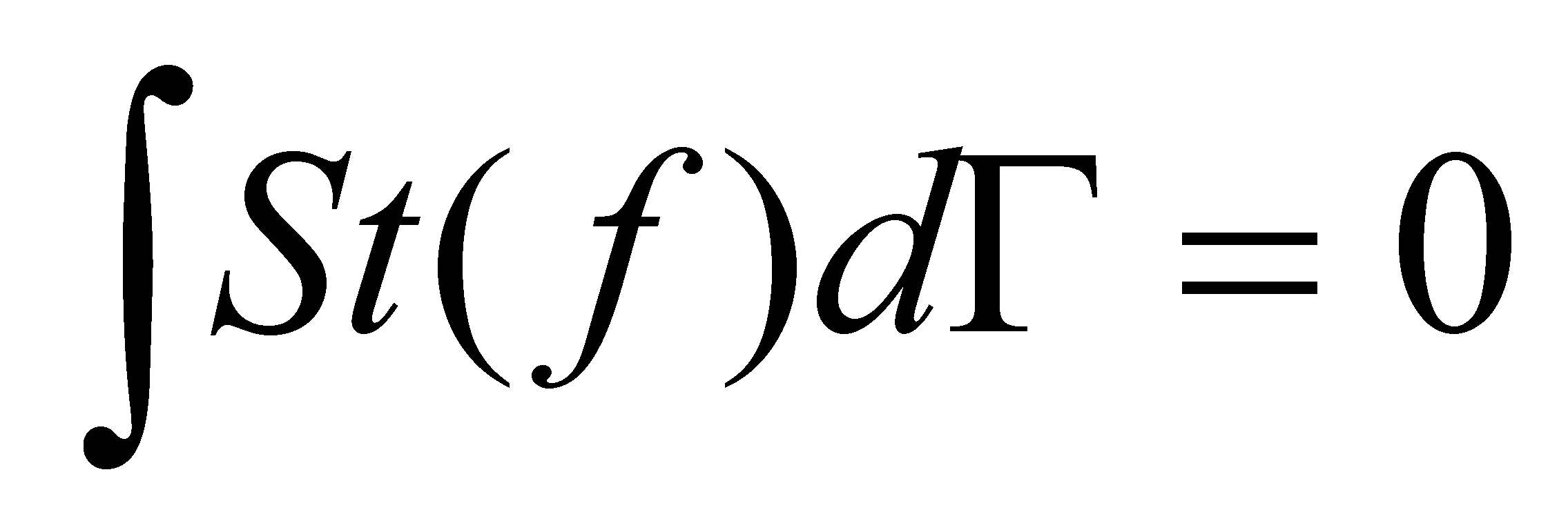
(14)

Убедимся в справедливости этого равенства следующим способом:
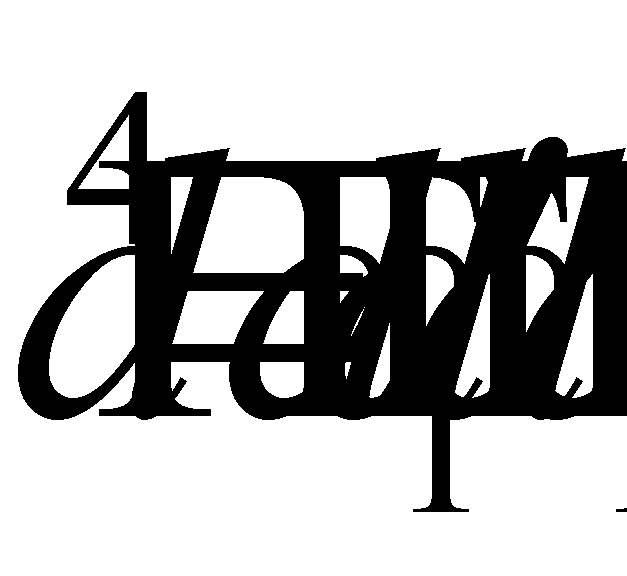
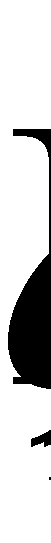
Интегрирование производится по каждой из переменых , а значит можно, не меняя интеграла, произвести переобозначение переменных, например, во втором интеграле :
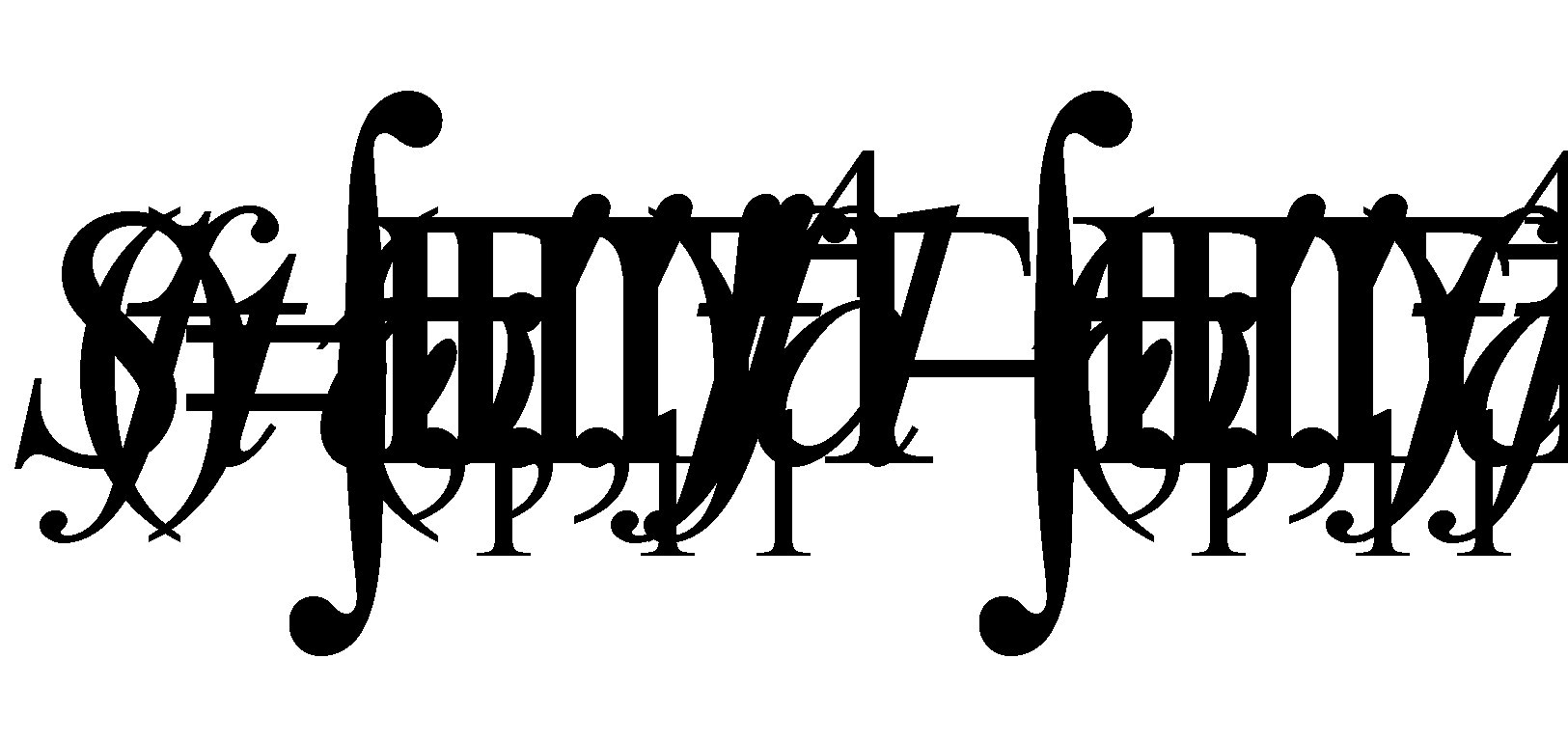
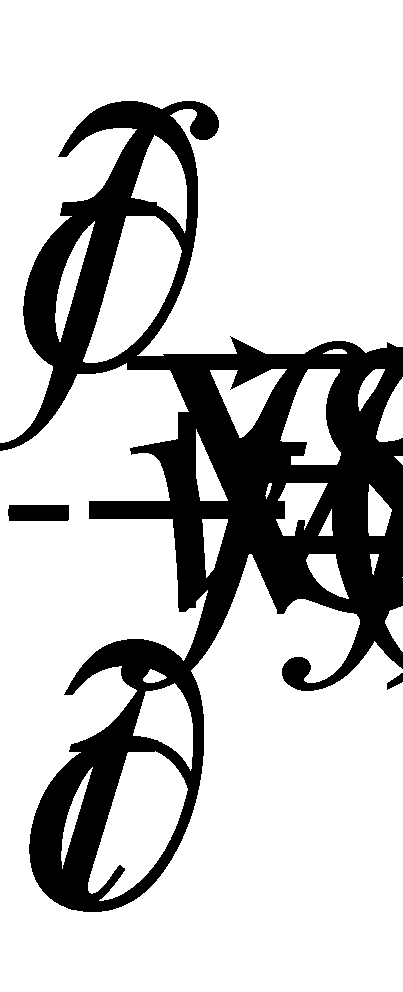
Последнее выражение, очевидно, равно нулю и, следовательно, справедливым является равенство (14).
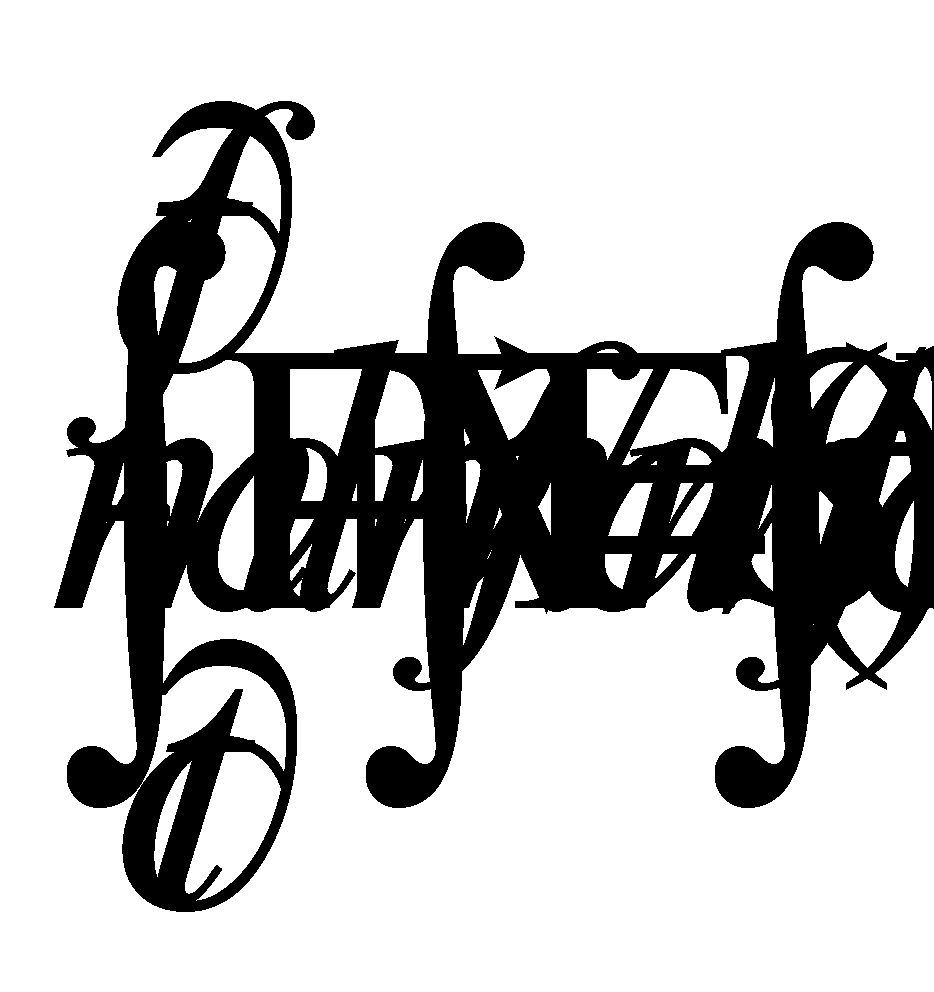
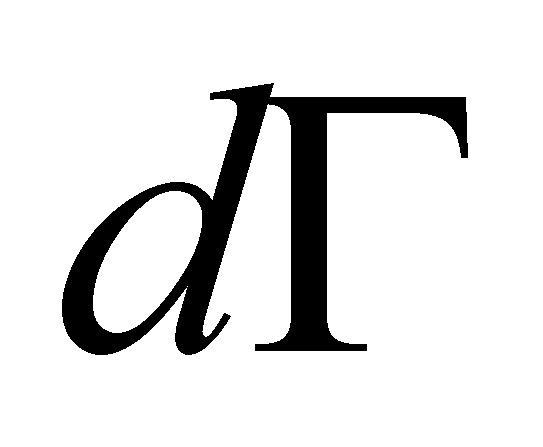
Запишем кинетическое уравнение и, предварительно умножив обе его части на массу частицы m , интегрируем его по :
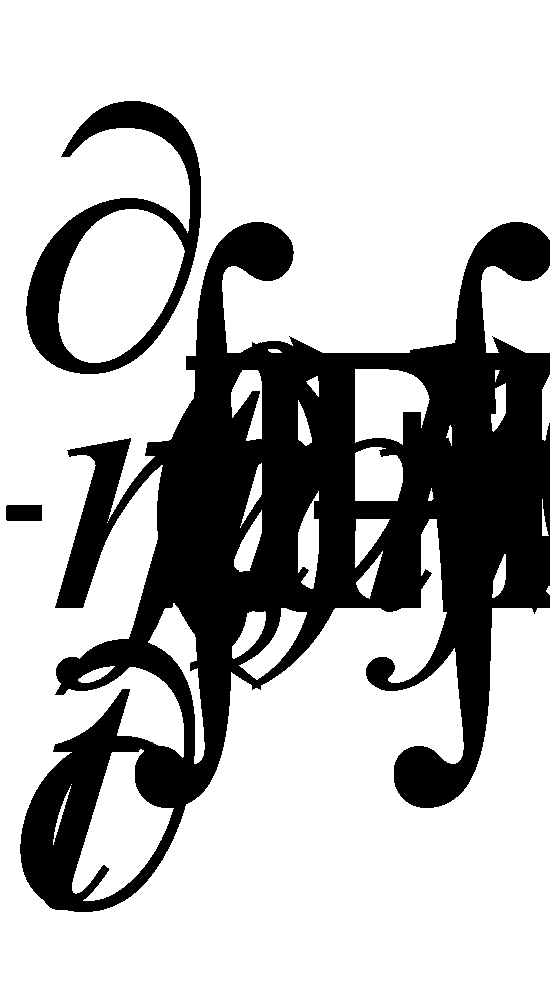
Отсюда немедленно получаем гидродинамическое уравнение непрерывности:
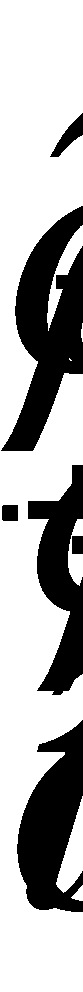
Задав в этом дифференциальном уравнении изменение плотности жидкости и считая жидкость несжимаемой, можно получить векторное поле направлений скоростей в любой точке жидкости.
§
4. Слабо неоднородный газ. Теплопроводность газа.
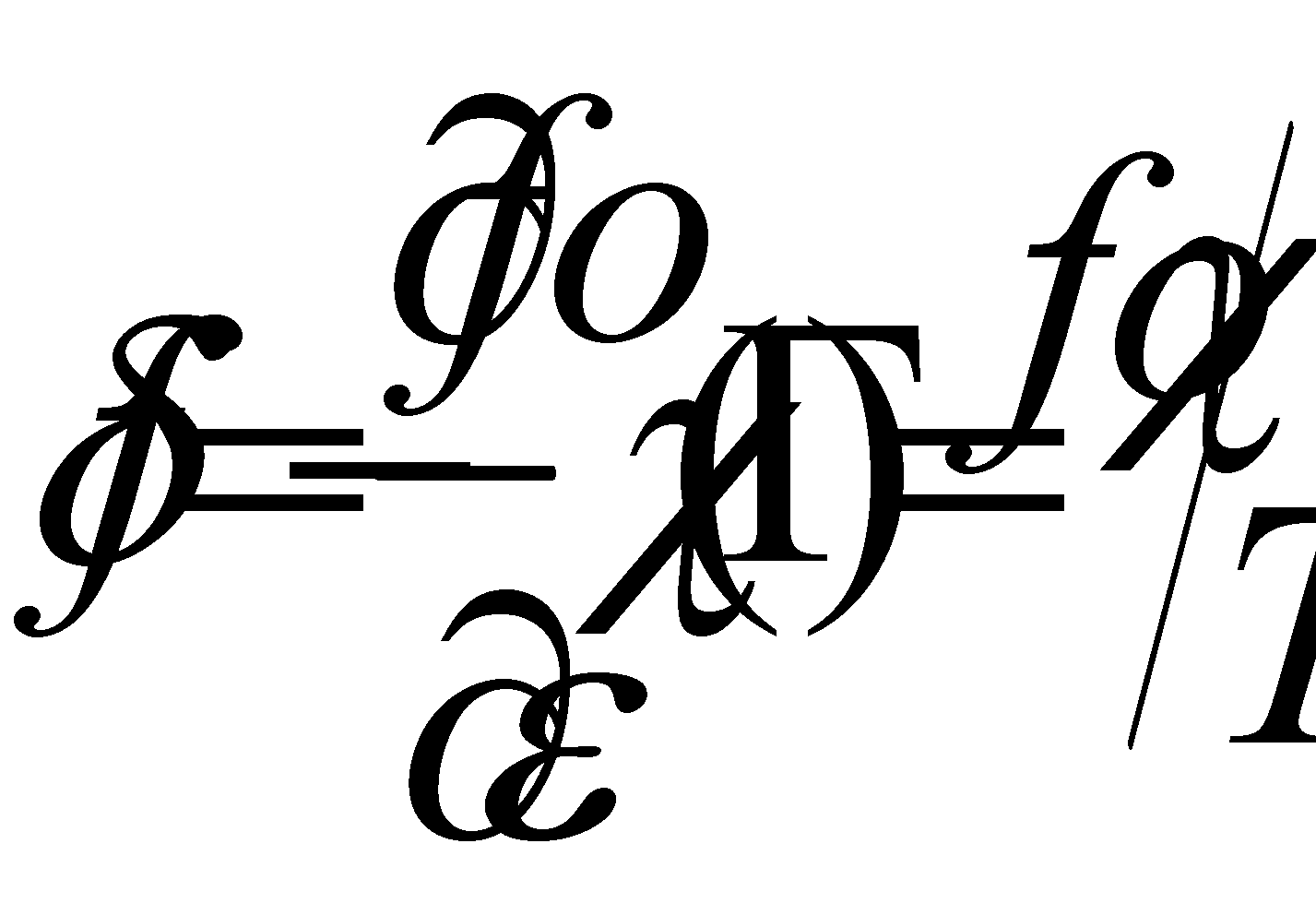
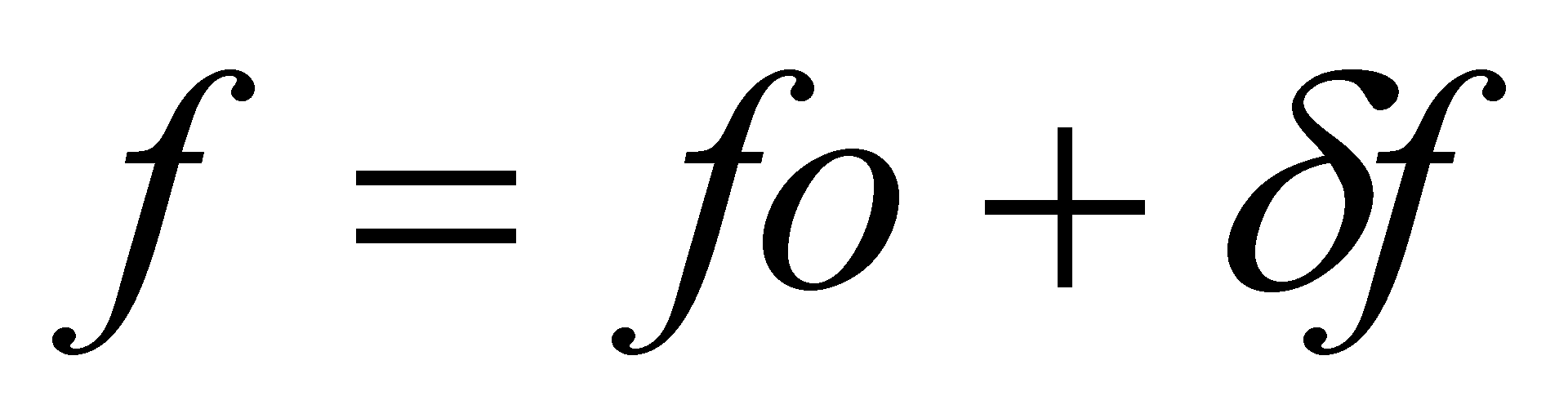
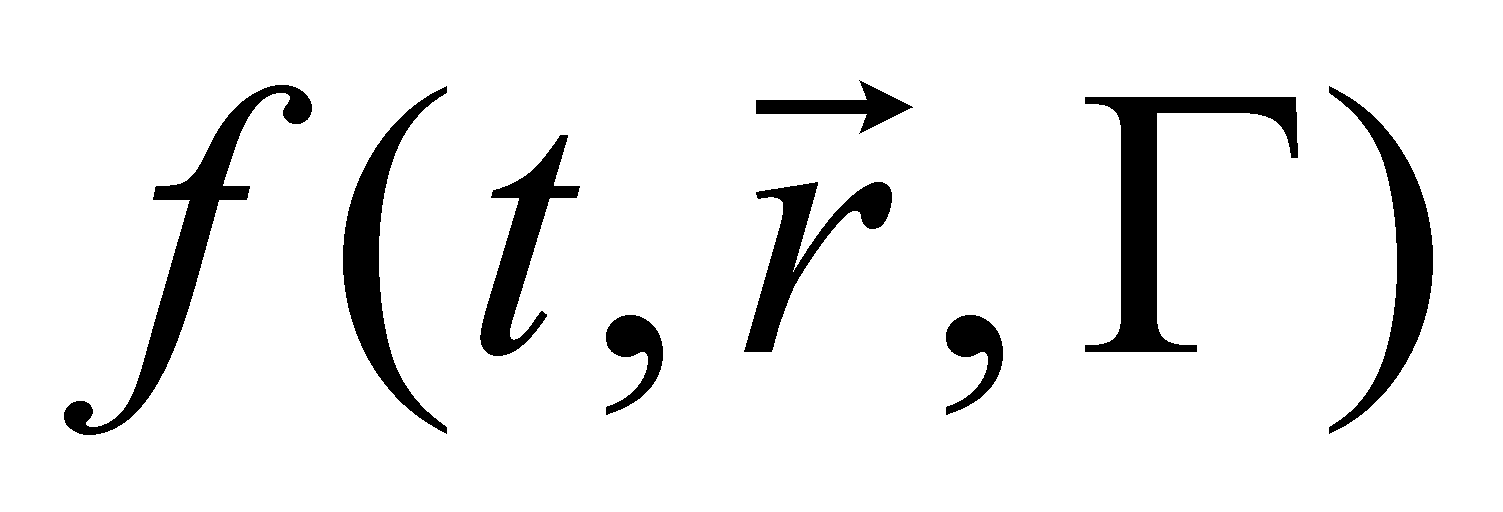
Все реальные физические процессы обязательно протекают с некоторыми потерями энергии (т.е. происходит диссипация энергии – переход энергии упорядоченного движения в энергию хаотического движения, например, в тепловое движение молекул газа). Для рассмотрения диссипативных процессов (теплопроводности или вязкости) в слабо неоднородном газе необходимо использовать следующее приближение: функцию распределения в малом участке газа следует считать не локально равновесной, как в случае однородного газа, а отличающейся от равновесной на некоторую достаточно малую (т.к. газ слабо неоднородный) величину . Функция распределения примет вид , а саму поправку запишем в виде . Функция должна удовлетворять определённым условиям. Если заданным плотностям числа частиц, энергии и импульса газа
т.е. интегралам отвечает равновесная функция , то неравновесная функция должна приводить к тем же значениям этих величин (интегралы с и должны совпадать ), что имеет место только когда
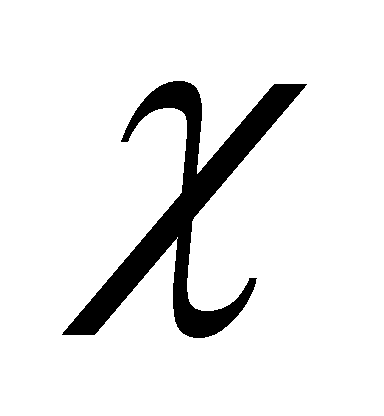
Преобразуем интеграл столкновений в кинетическом уравнении (13): подстановка выражений функции распределения и поправки , обнуление интегралов столкновений,содержащих равновесную функцию распределения, сокращение членов , не содержащих малой поправки . Члены первого порядка дадут . Символ введен для обозначения линейного интегрального
 оператора
оператора
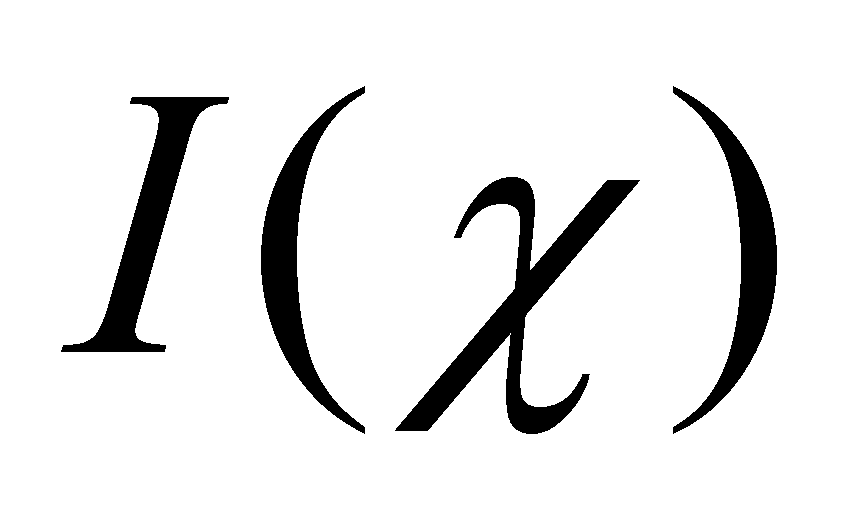
Указанный интеграл обращается в нуль для функций вида
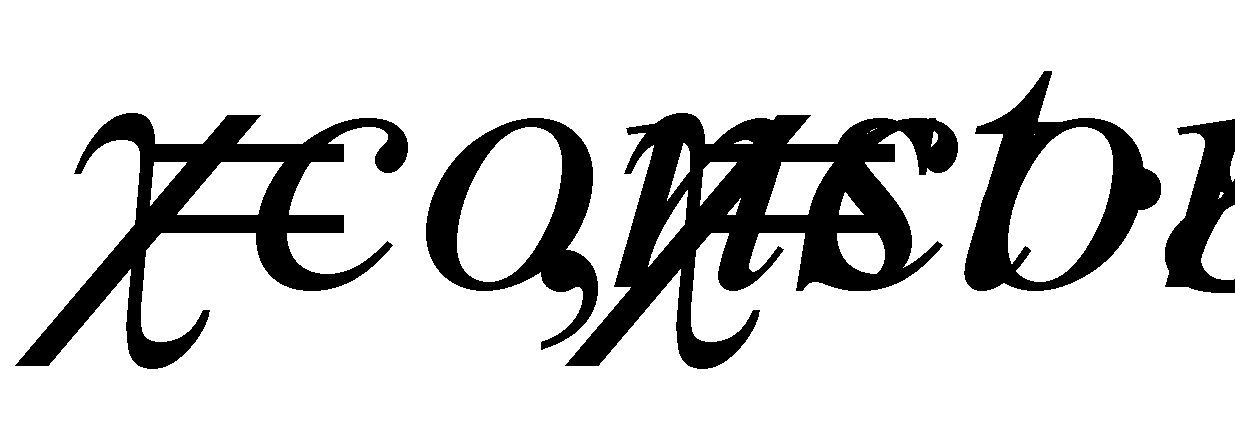
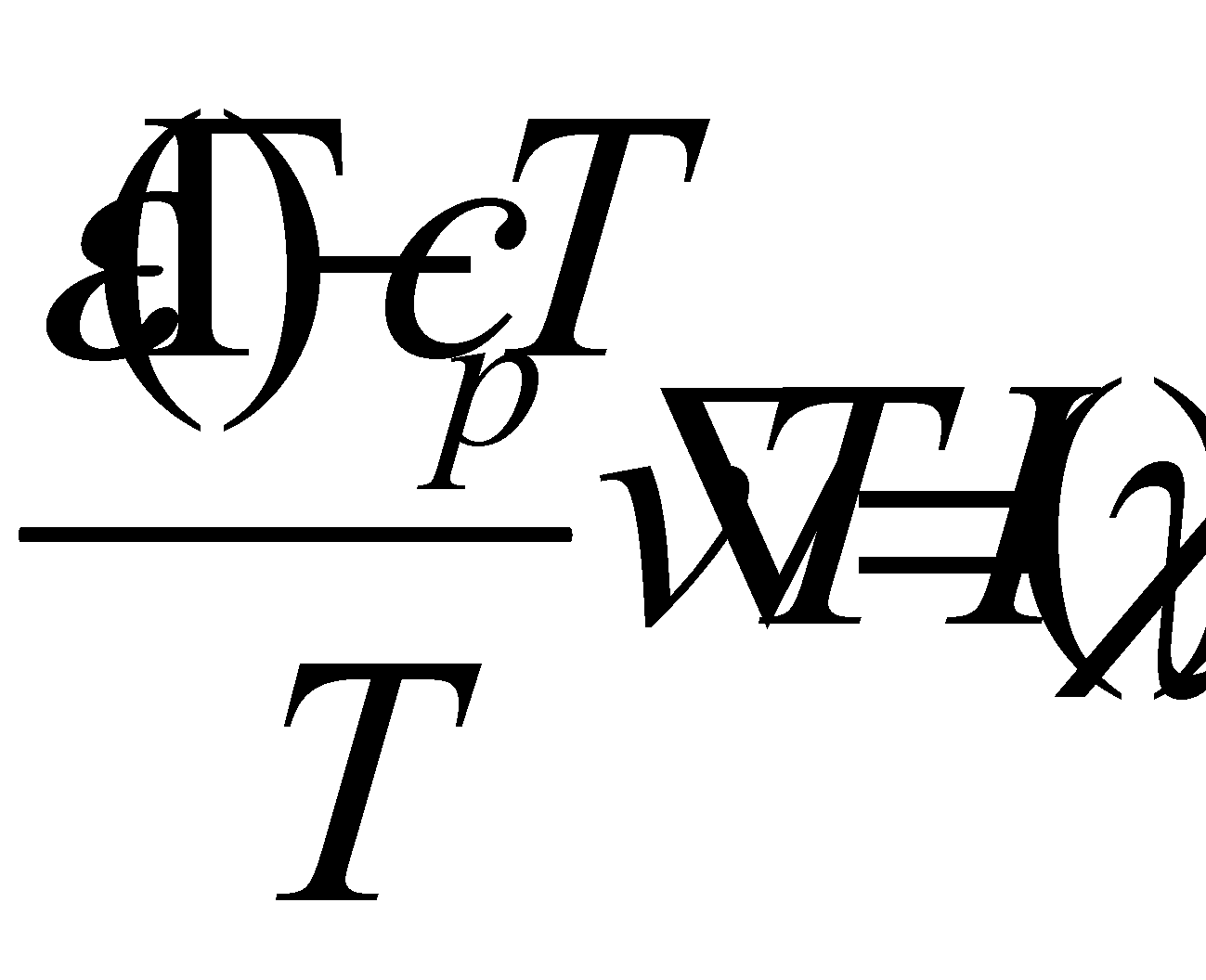
Запишем (без вывода) кинетическое уравнение для слабо неоднородного газа., сохранив для рассмотрения задачи о теплопроврдности в левой части уравнения только одно слагаемое с градиентом температуры
*************************************************
§
4.
Вычисление коэффициента теплопроводности одноатомного газа
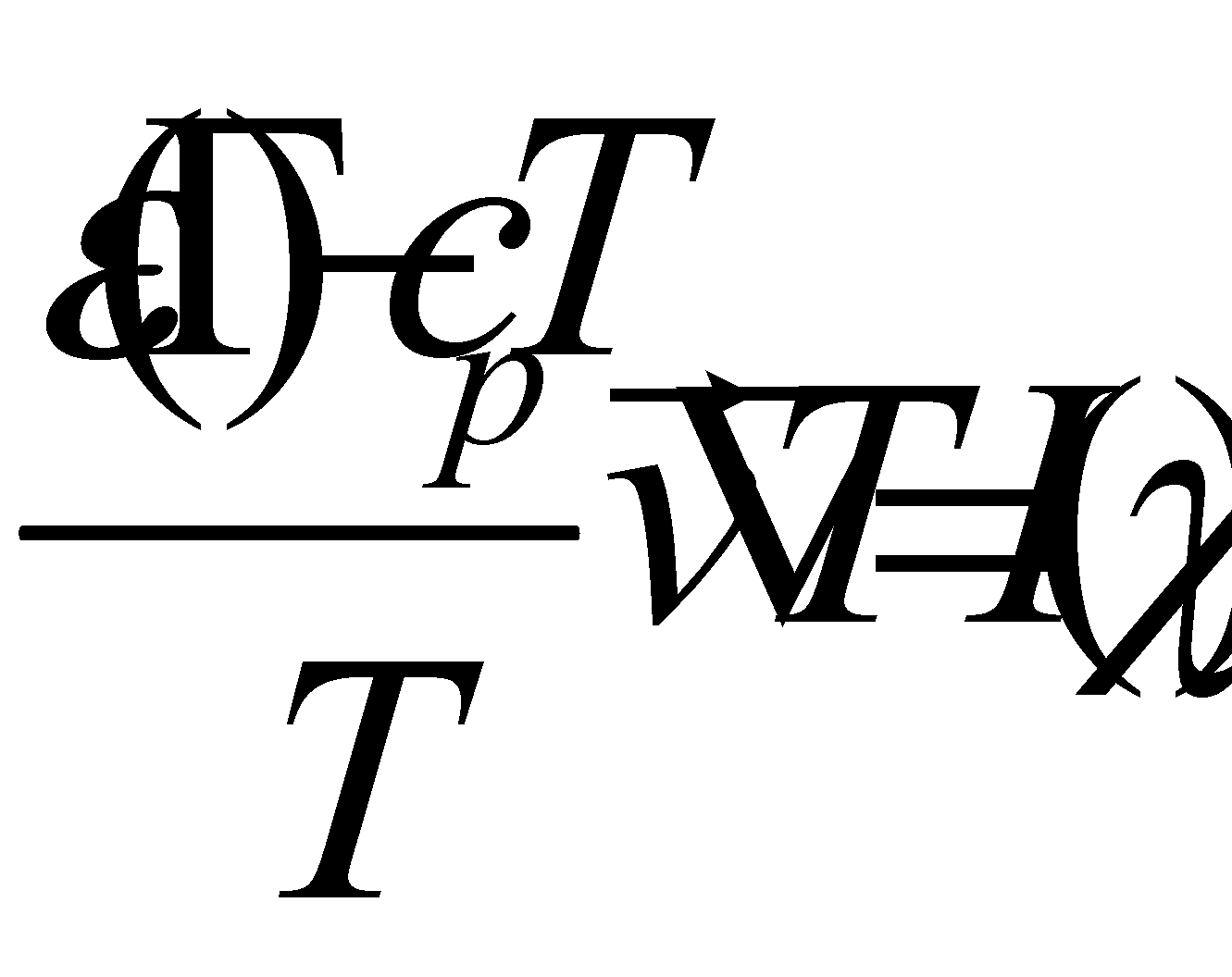
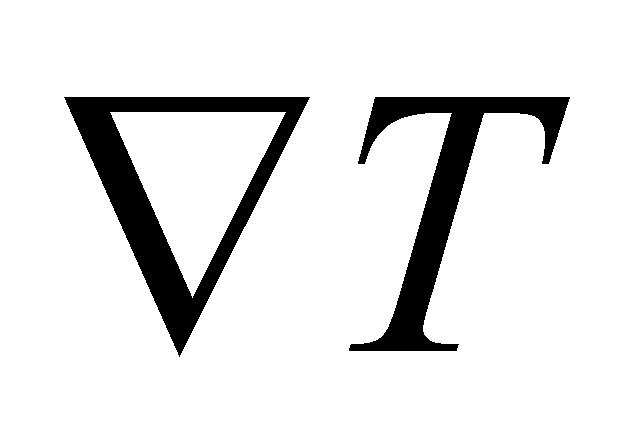
Для вычисления коэффициента теплопроводности газа необходимо решать записанное выше уравнение с градиентом температуры .
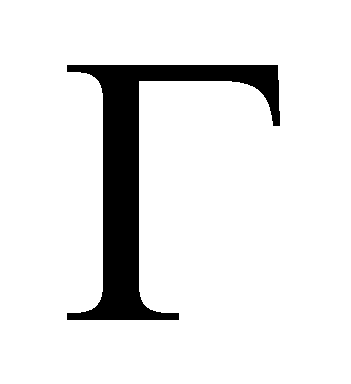
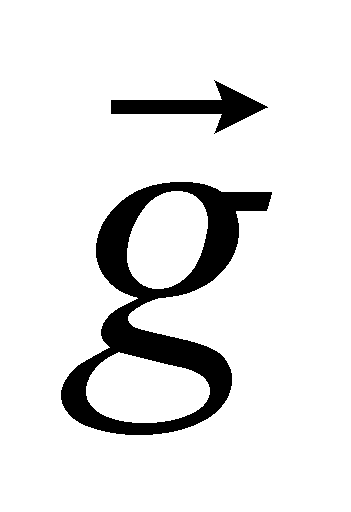
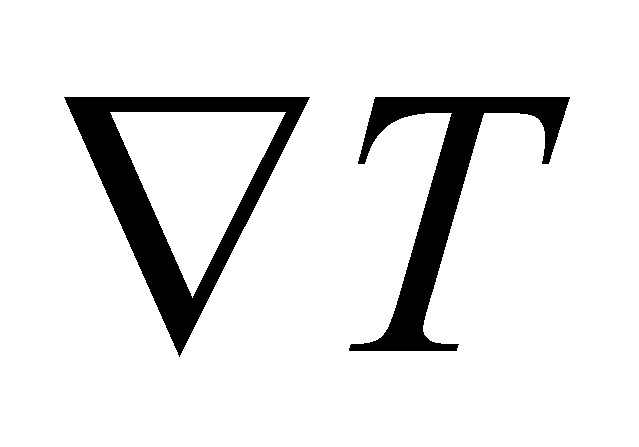
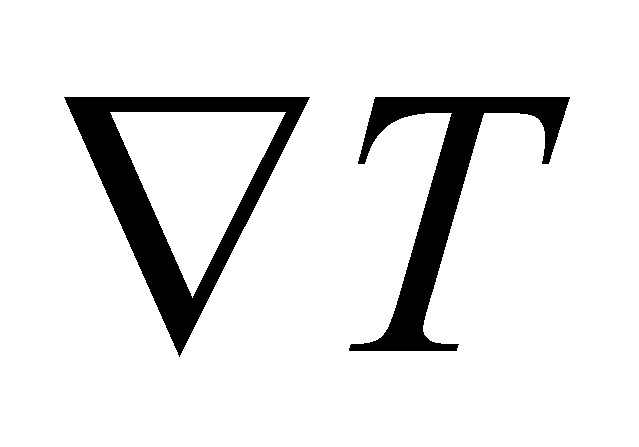
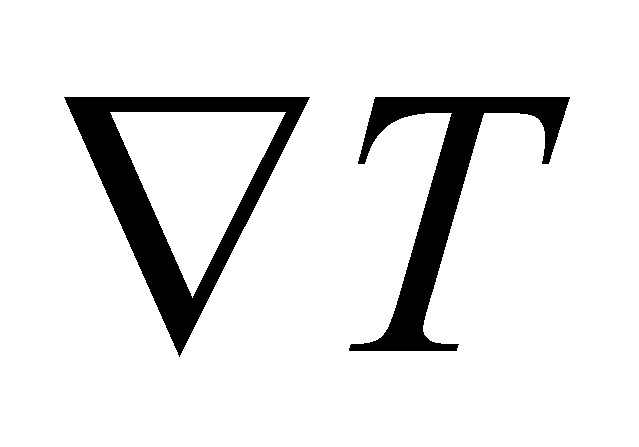
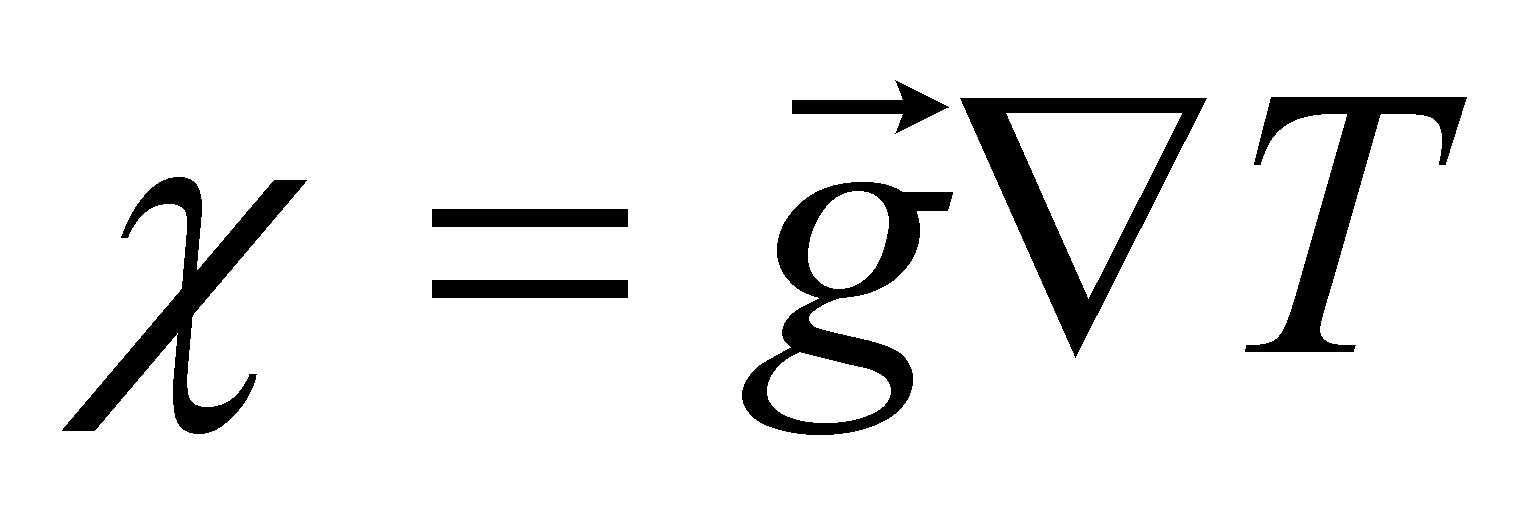
Пусть - вектор-функция только величин . Тогда решение уравнения () будем искать в виде . При подстановке этого решения в уравнение () получаем множитель . Уравнение () справедливо при совершенно произвольных значениях вектора градиента
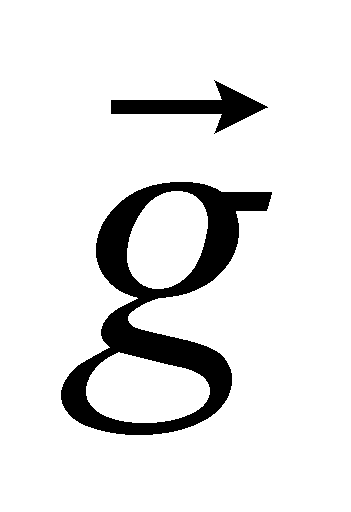 температуры , тогда должны быть равными коэффициенты при в обеих частях равенства. В итоге для получаем уравнение
температуры , тогда должны быть равными коэффициенты при в обеих частях равенства. В итоге для получаем уравнение
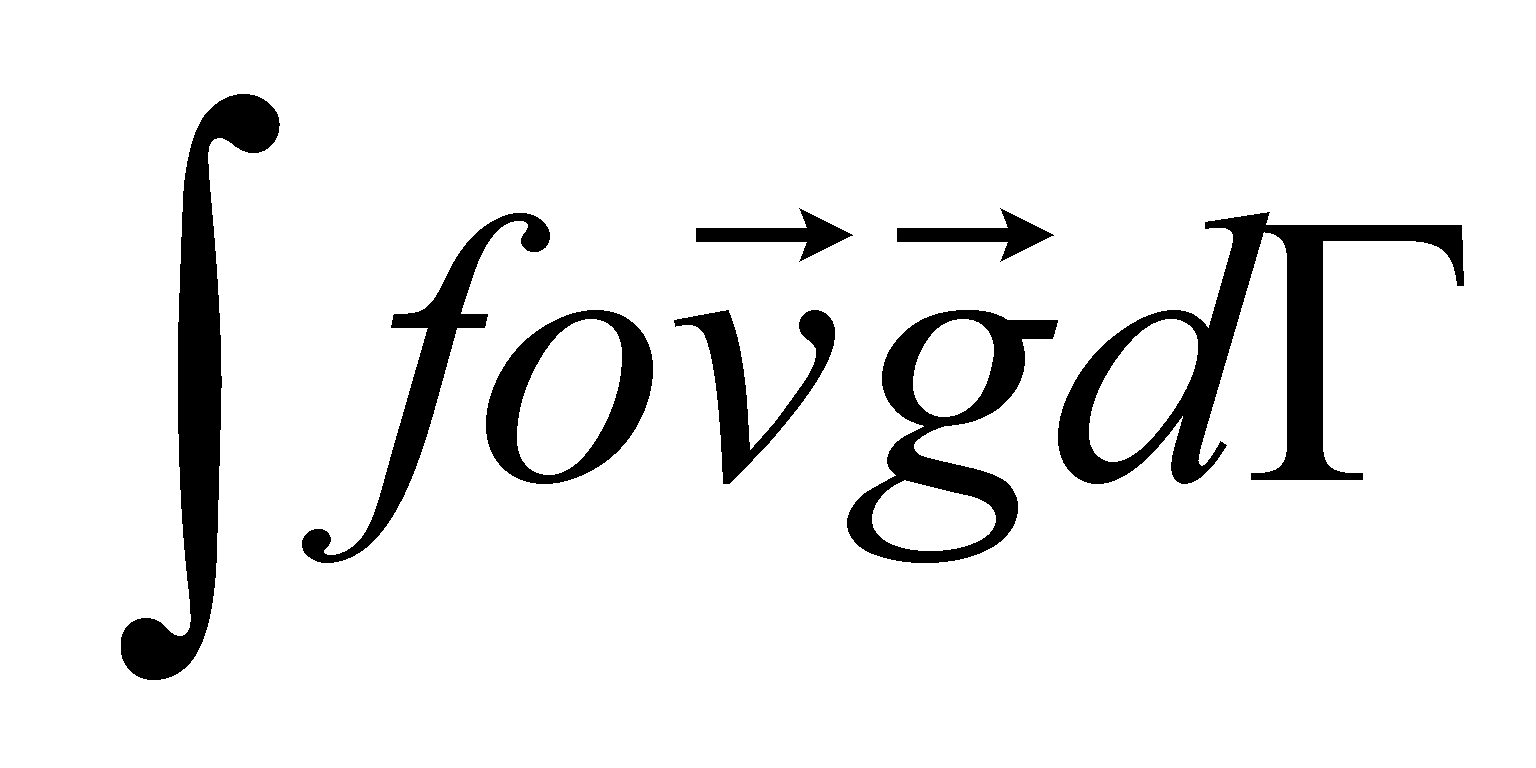
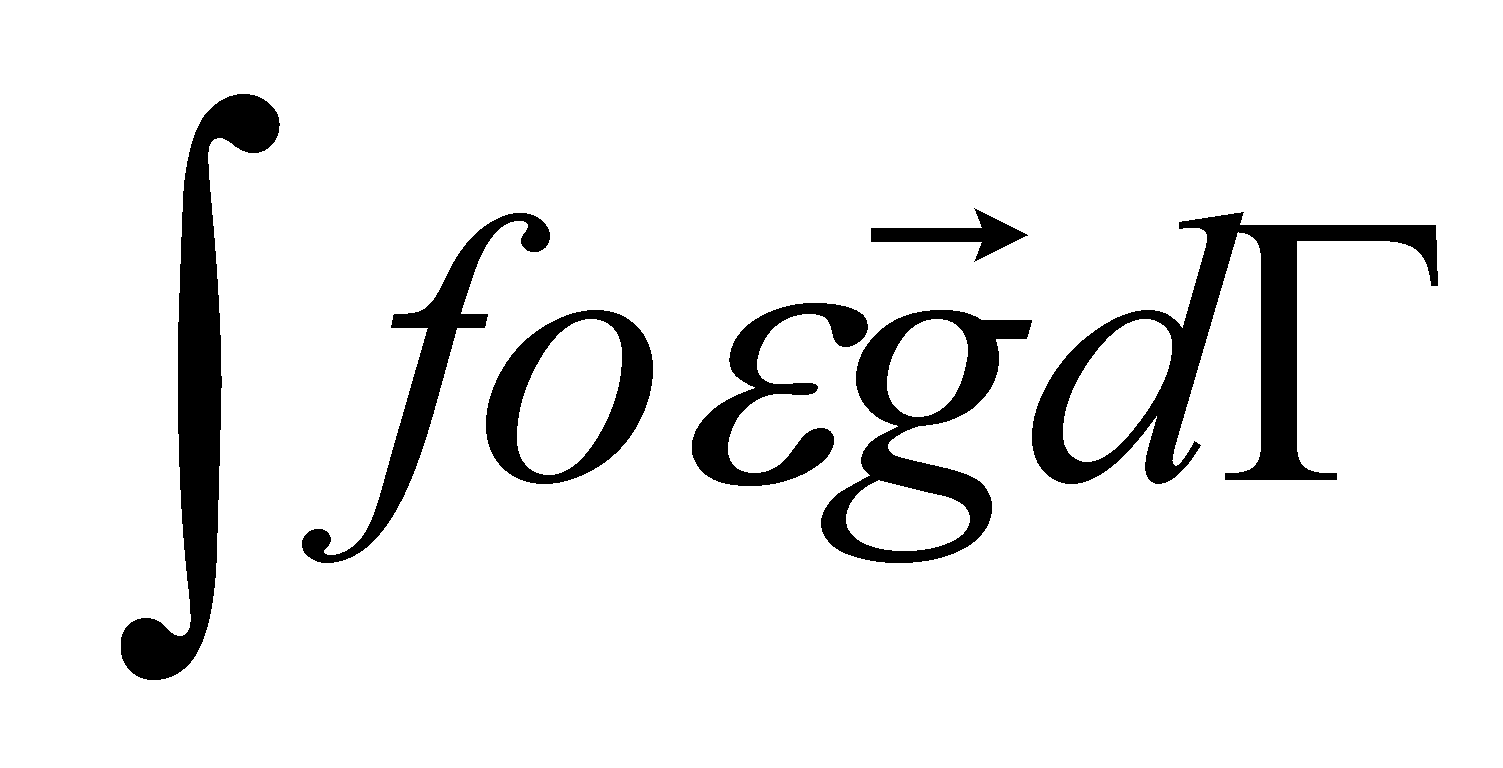
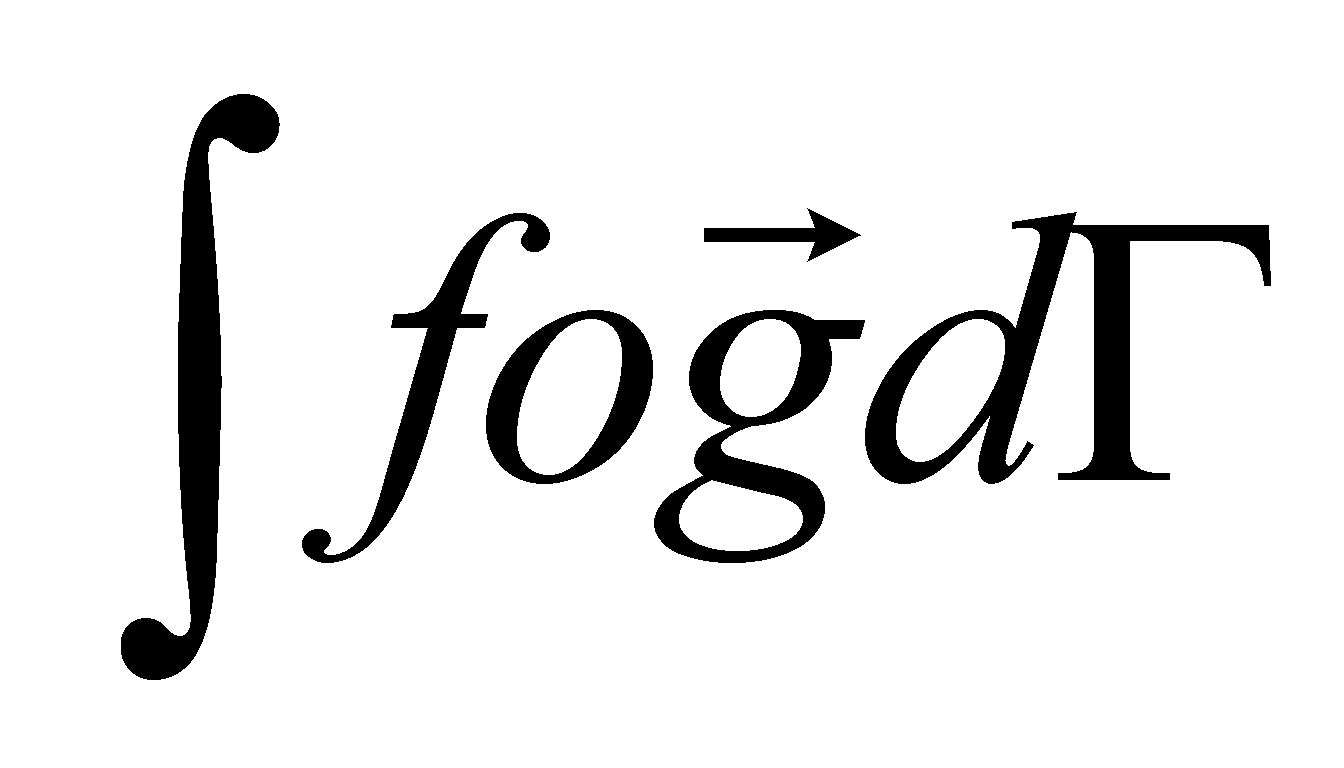
Уравнение не содержит градиента температуры и значит не имеет явной зависимости от координат. Функция обязательно должна удовлетворять указанным ранее условиям (). Первые два условия, очевидно, выполняются ( уравнение () не содержит никаких векторных параметров, вдоль которых могли бы быть направлены постоянные векторы- интегралы
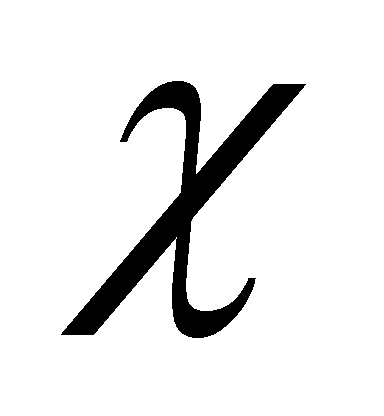
И ). Третий интеграл представляет из себя дополнительное условие на функцию g. Если кинетическое уравнение решено и функция
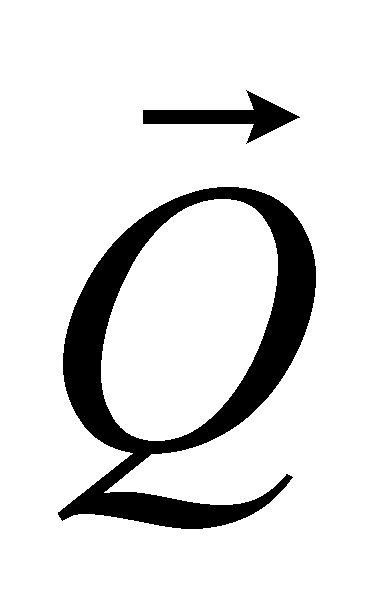
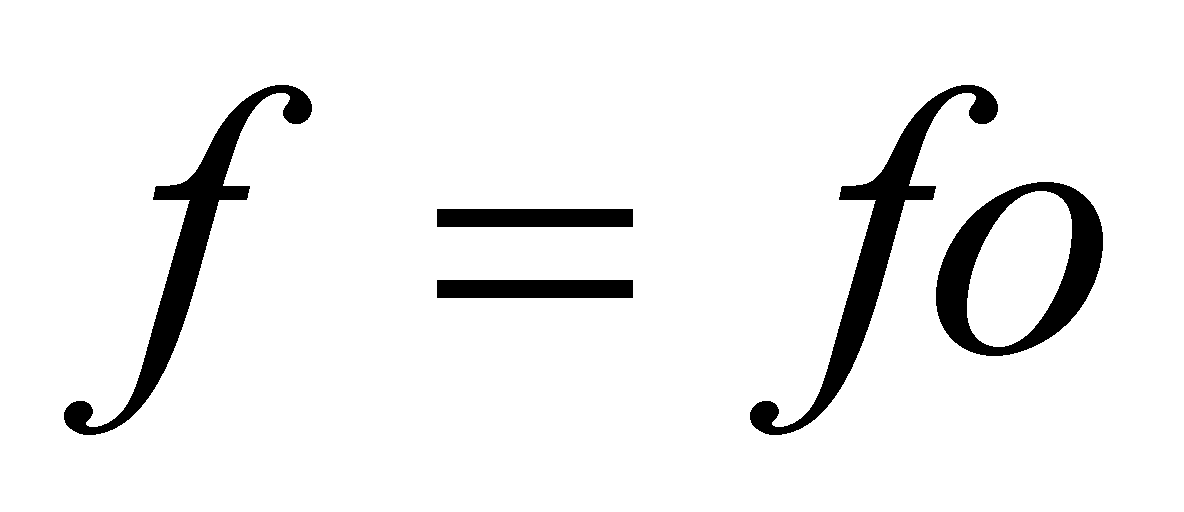
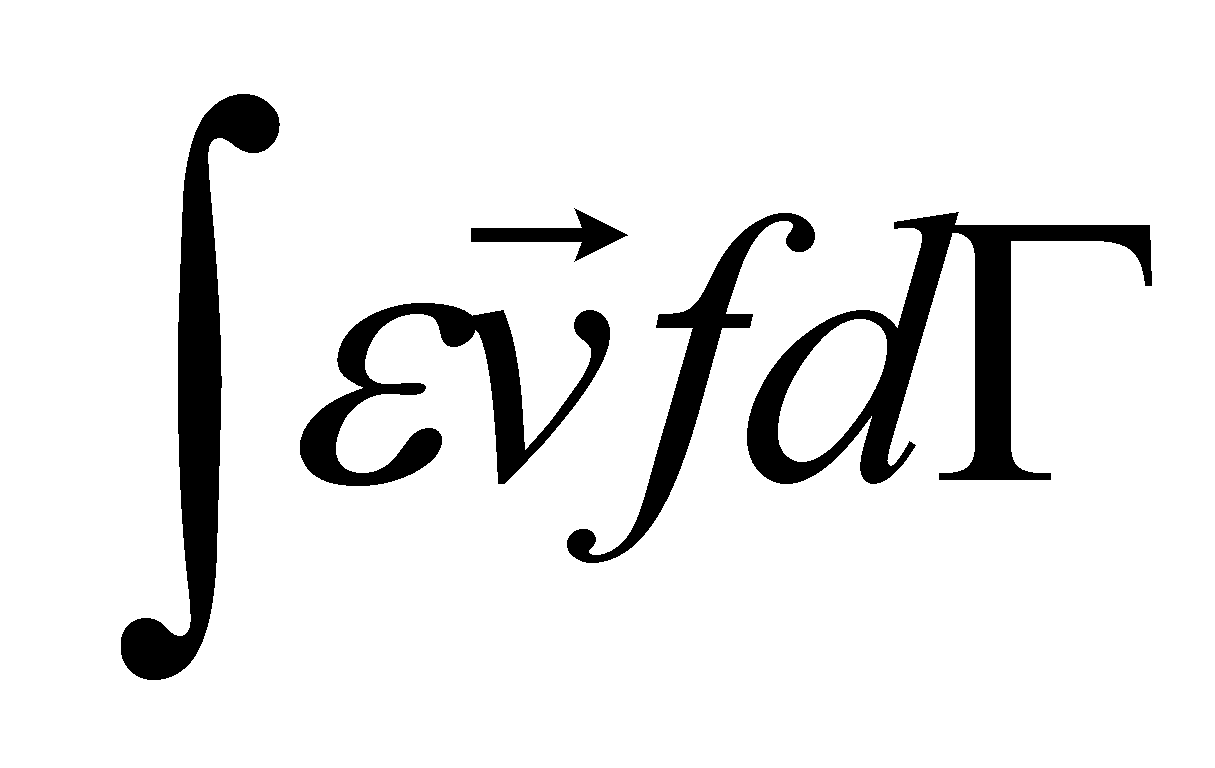
определена, то можно определить коэффициент теплопроводности, вычисляя поток энергии, точнее - его диссипативную часть, не связанную с конвективным переносом энергии (обозначим эту часть потока энергии через ). В отсутствии макроскопического движения в газе Q совпадает с полным потоком энергии Q, который может быть выражен через интеграл
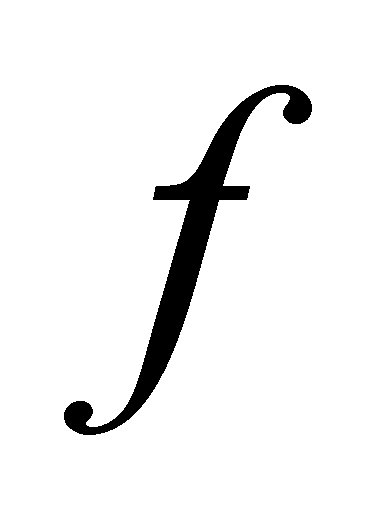

Если система находится в рановесии , то и этот интеграл равен нулю за счёт интегрирования по всем возможным направлениям в газе. При подстановке в () остаётся

В компонентах
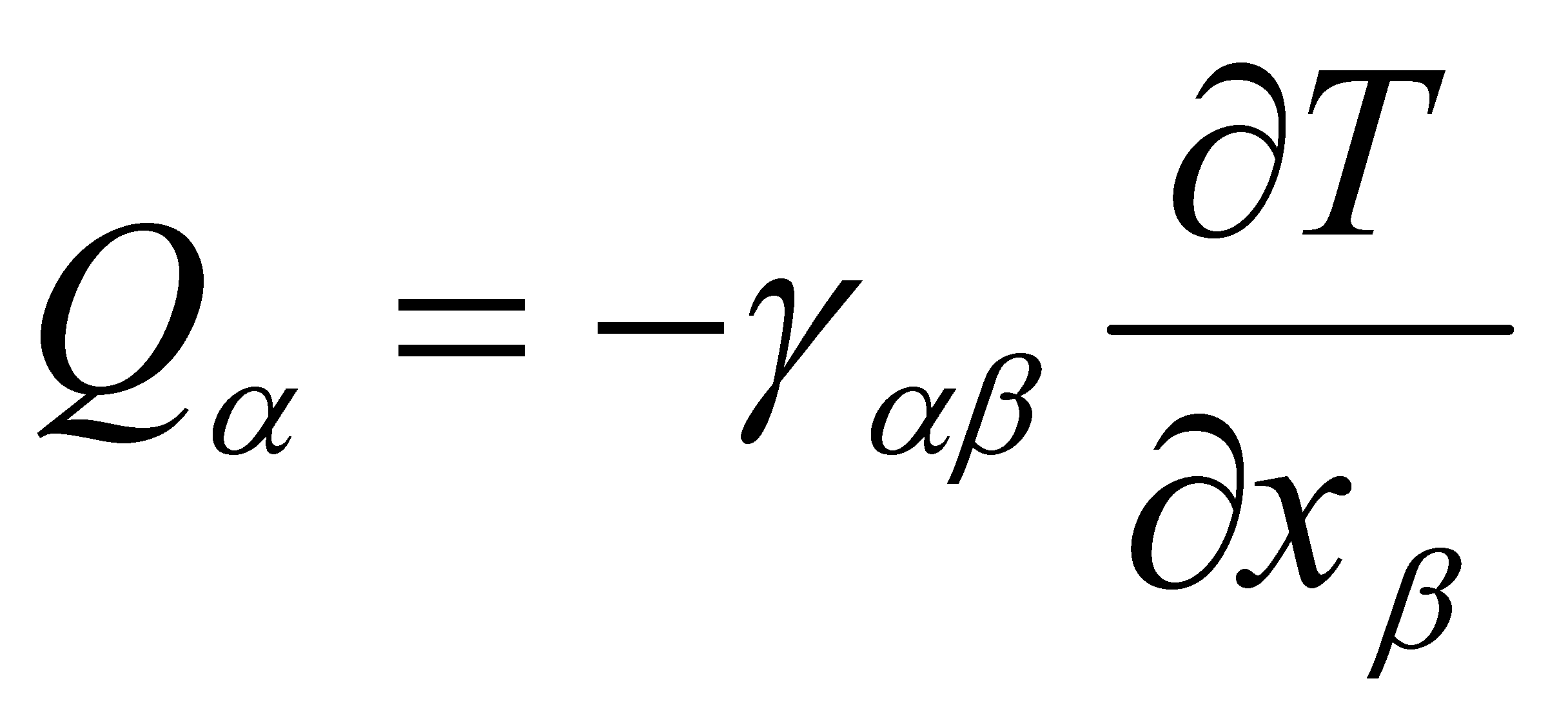
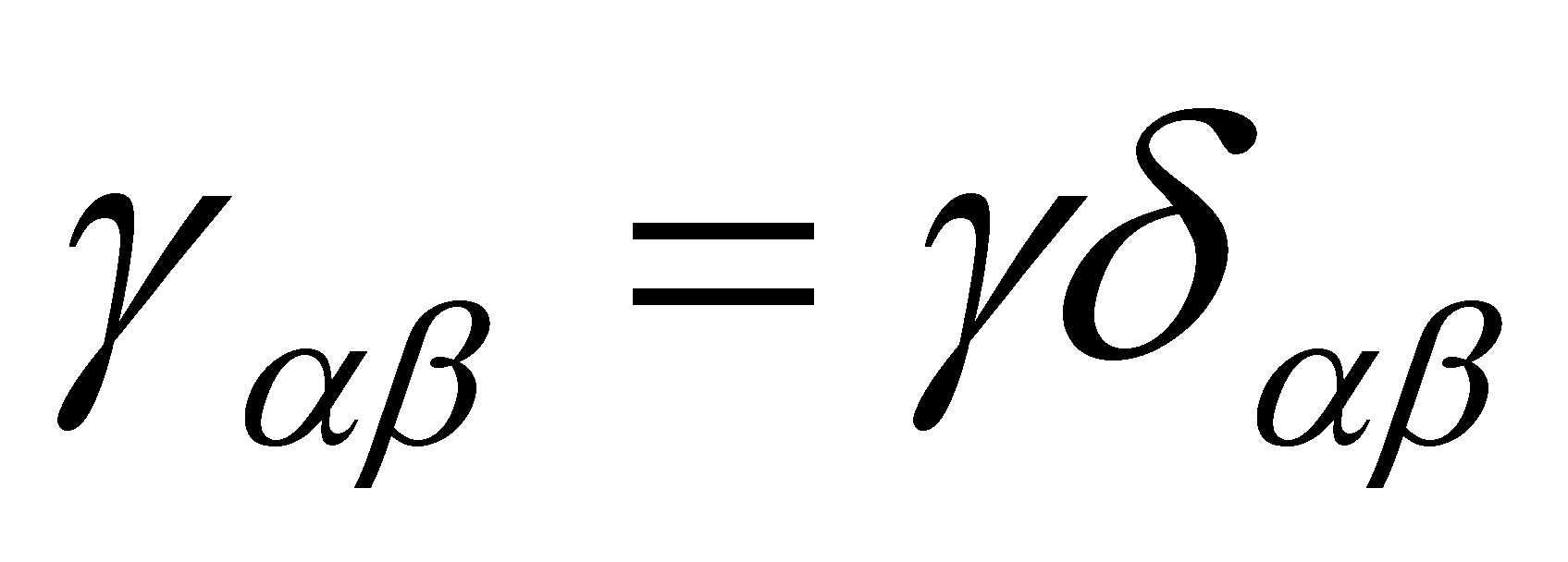
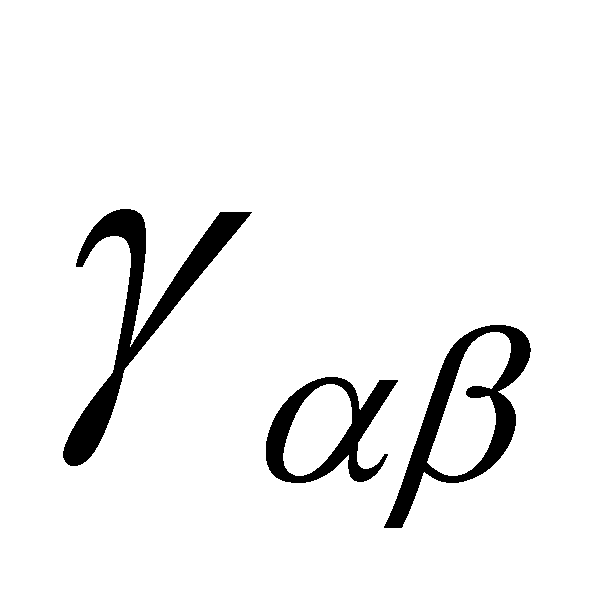
Ввиду изотропии среды равновесного газа какие либо избранные направления в нём отсутствуют и тензор может выражаться лишь через единичный тензор ,т.е. сводится к скаляру
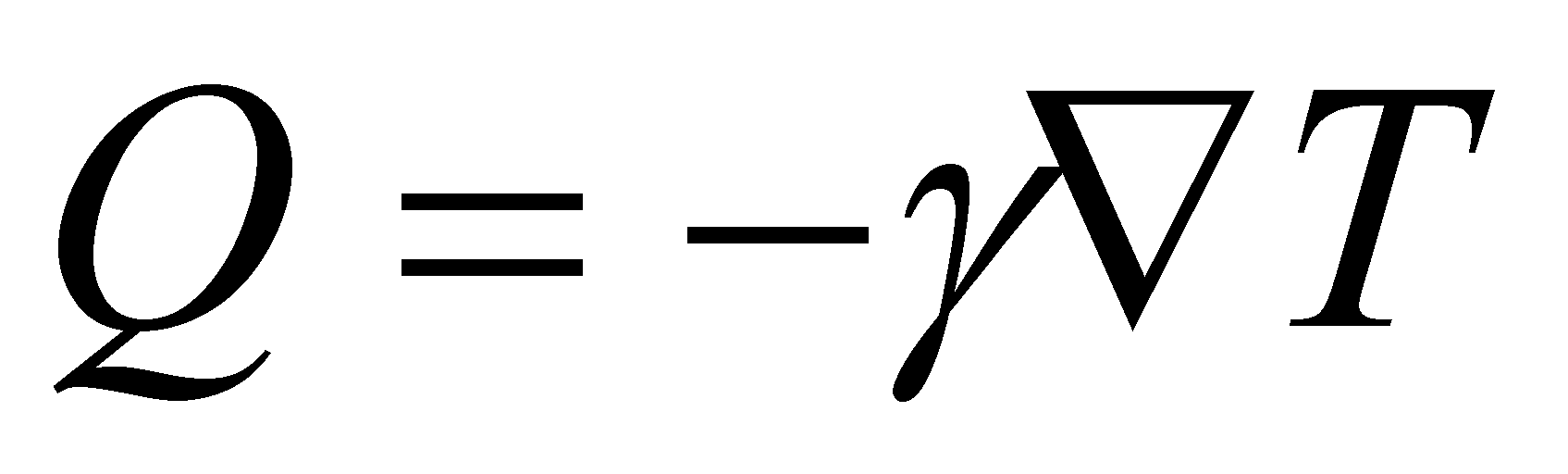
Таким образом поток энергии выражается как , где величина есть скалярный коэффициент теплопроводности
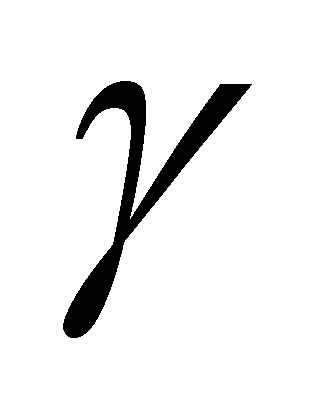
Поток Q должен быть направлен в сторону, противоположную градиенту температуры, а величина соответственно должна быть положительна, что автоматически обеспечивается кинетическим уравнением (). В одноатомных газах скорость v- единственный вектор от которого зависит функция g ( в многоатомных газах имеет место зависимость g не только от скорости v , но и отмомента M). Для одноатомных газов функция g имеет вид:
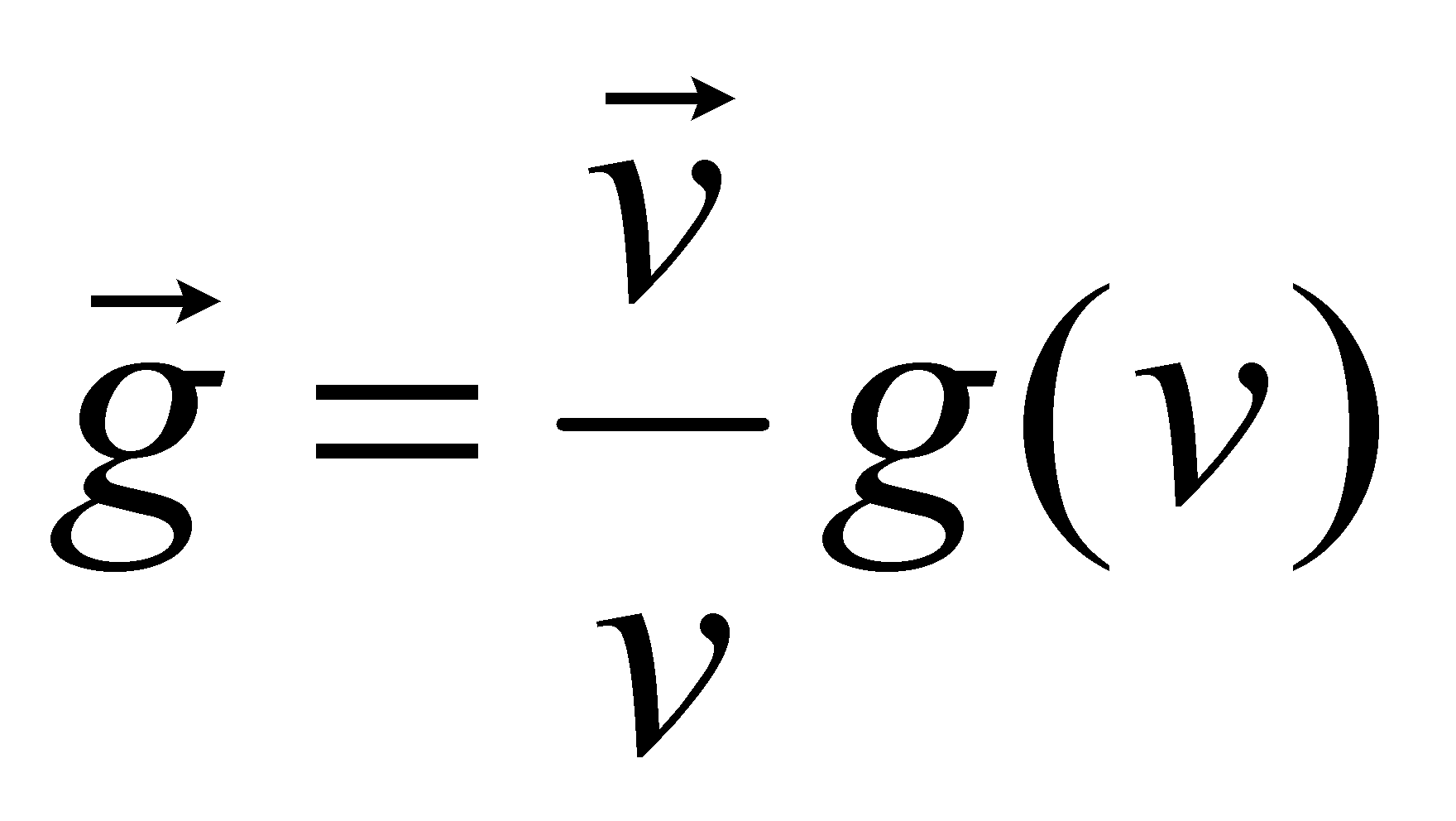
.
§
5.
Пример решения кинетического уравнения
Молекулы газа взаимодействуют по достаточно сложным законам. Это особенно касается реальных многоатомных газов. Сделанные допущения относительно характера поведения молекул газа позволяют упростить рассуждения (или даже сделать их в принципе возможными), но несколько удаляют нас от реальности. Сложные законы взаимодействия молекул, определяющие функцию в интеграле столкновений, не позволяют даже записать уравнение Больцмана для конкретных газов в точном виде. Даже при упрощении характера молекулярного взаимодействия математическая структура кинетического уравнения остаётся достаточно сложной, и нахождение его решения в аналитическом виде затруднительно. В кинетической теории газов применяют особые, более эффективные, чем попытка аналитического решения, методы приближенного решения уравнения Больцмана. В качестве примера рассмотрим одноатомный газ и задачу о теплопроводности.

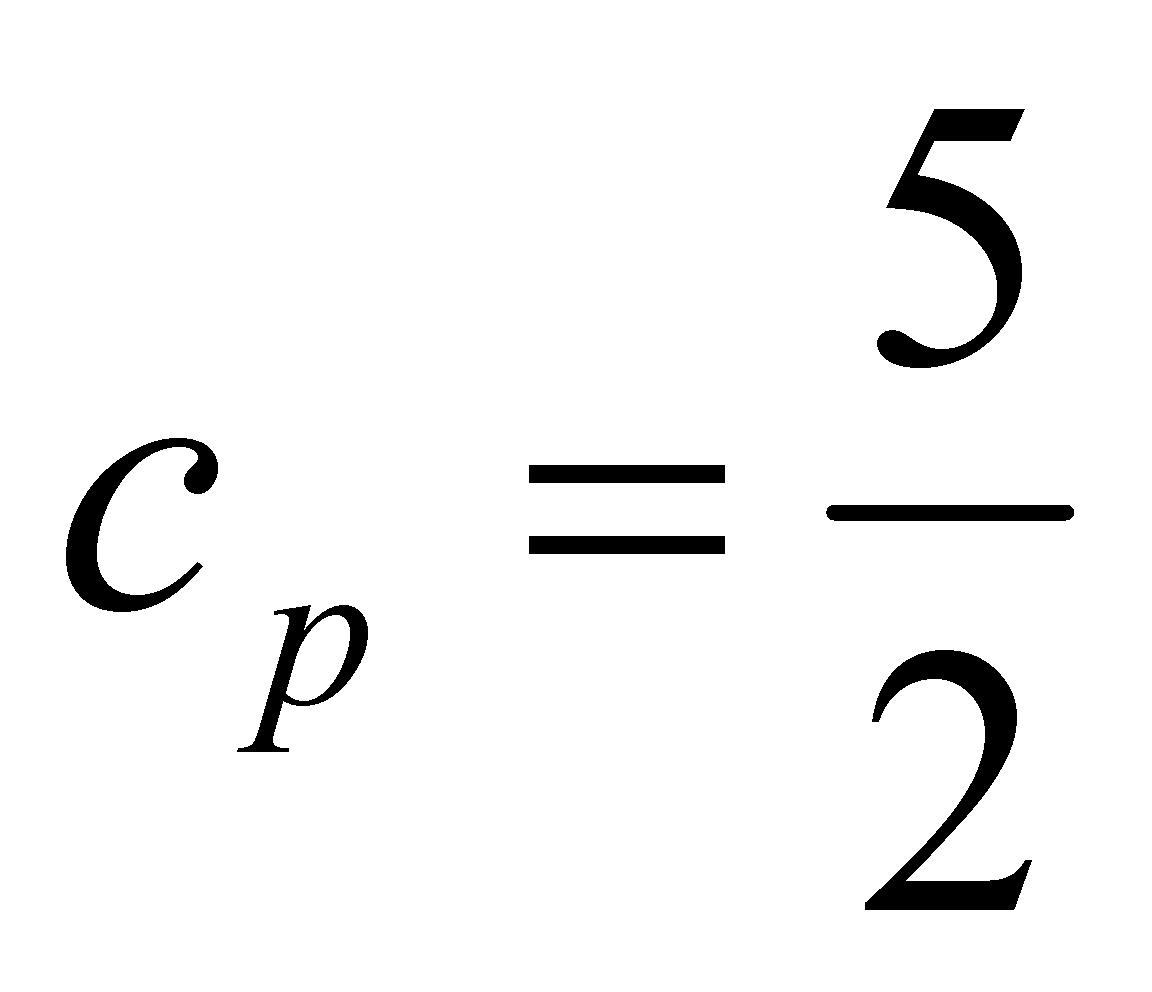
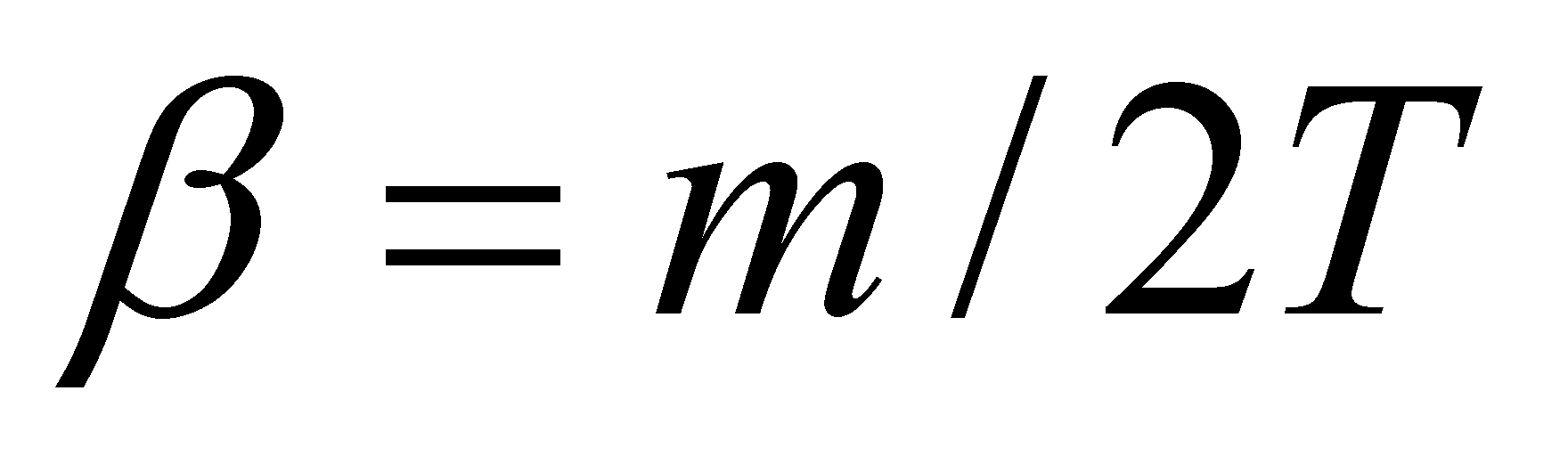
Для одноатомного газа теплоёмкость . Положив уравнению ( ) придадим вид
Линейный интегральный оператор, соответствующий интегралу столкновений ( ) ,определяется формулой
а равновесная функция распределения примет вид .
Эффективный метод приближённого решения уравнения ( ) основан на разложении искомых функций по полной системе взаимно ортогональных функций. В качестве таких функций рассмотрим полиномы Сонина, определяемые формклами :
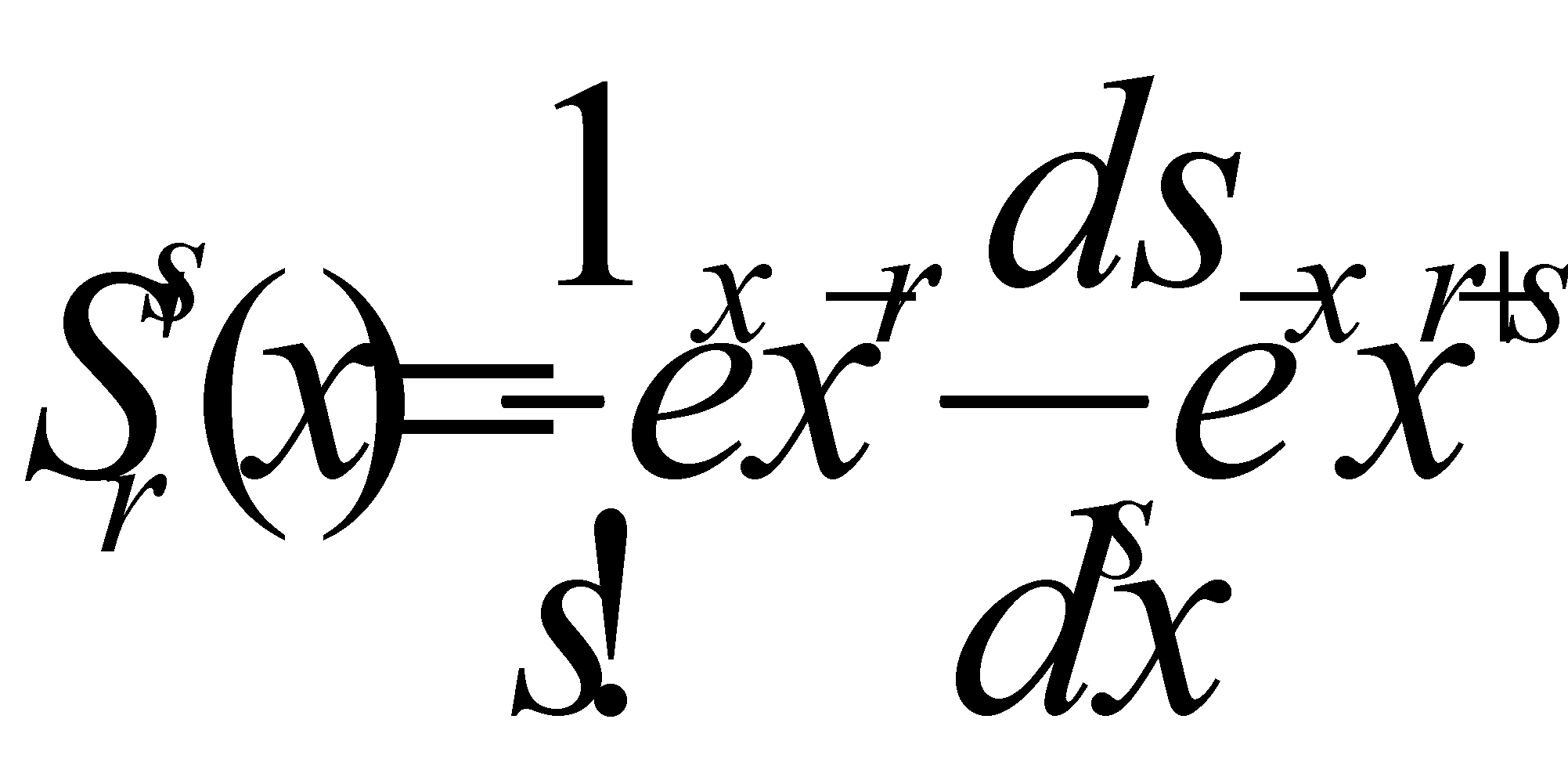
В этой формуле r – произвольное, а s – целое положительное число либо нуль. В честноти
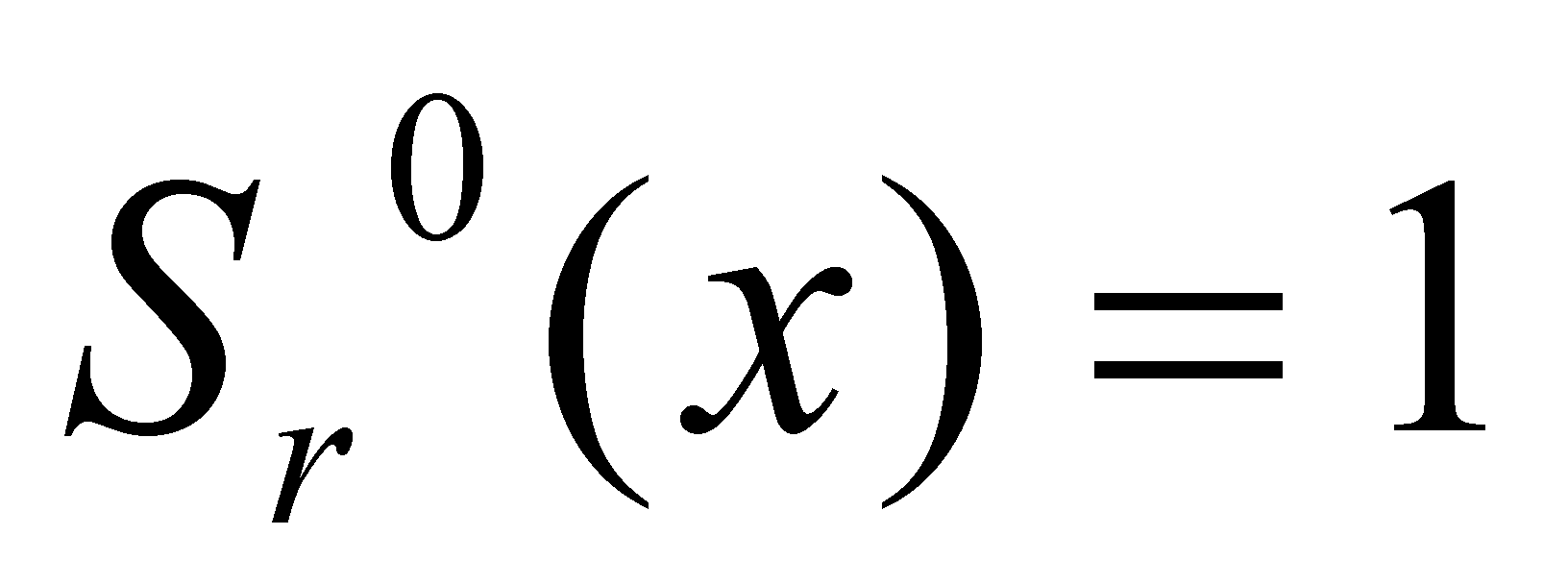
Свойство ортогональности этих полиномов при заданном индексе r и различных индексах s выаглядит следующим образом
Решение уравнения ищем в виде следующего разложения
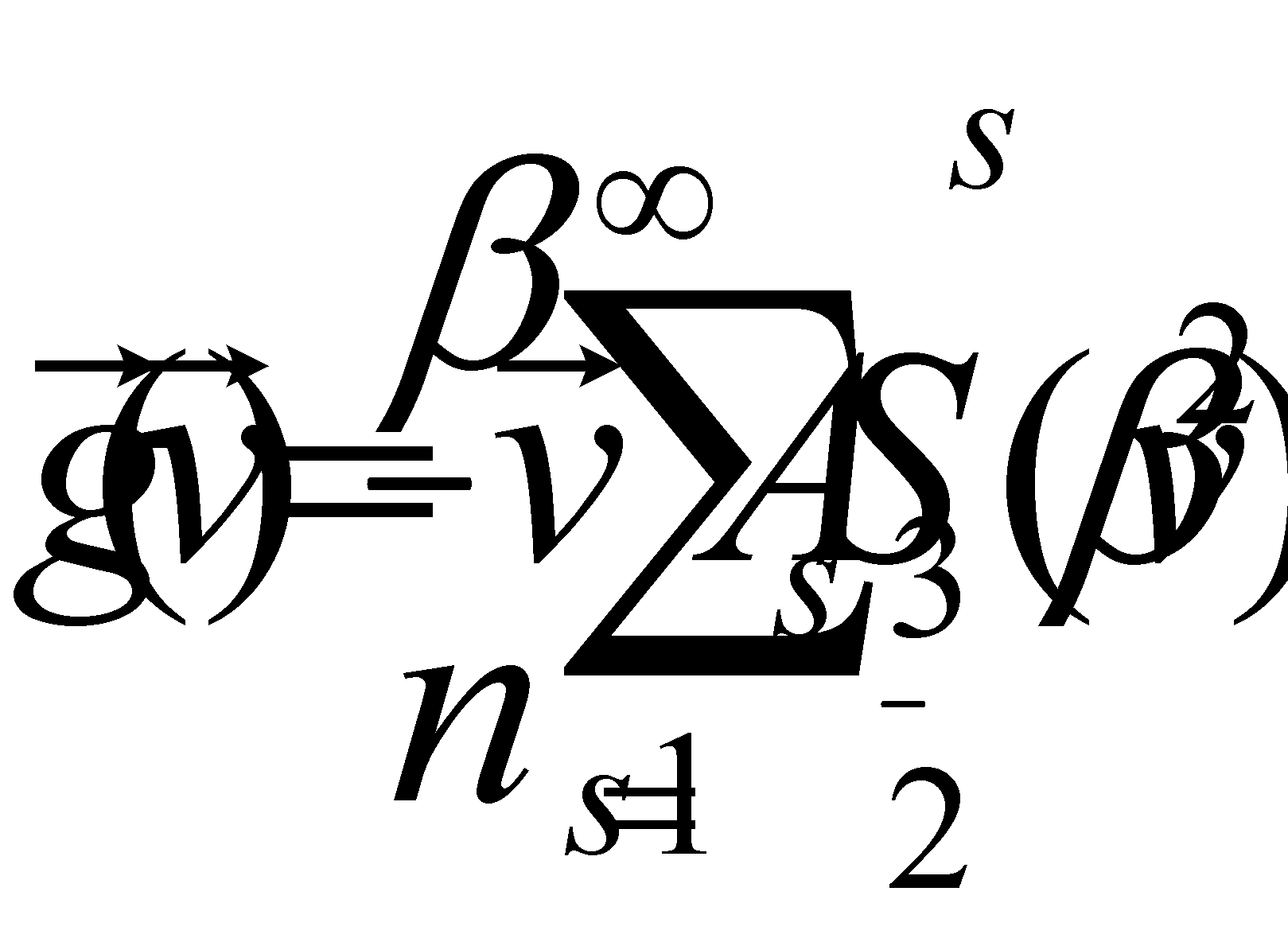
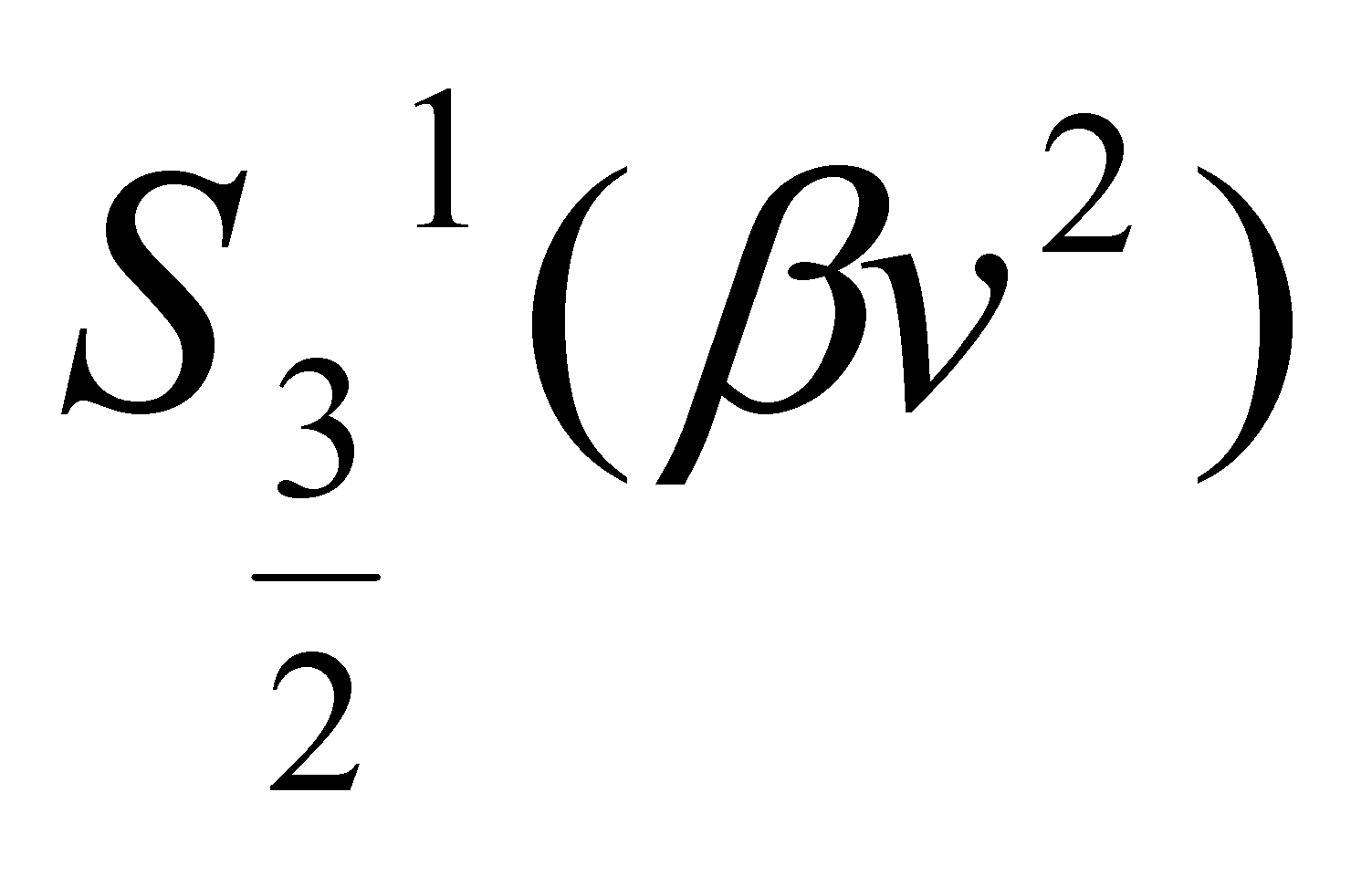
Опустив в разложении член с s=0 , получим выражение адовлетворяющее () (нтеграл обнуляется в силу ортогональности полиномов с различными s ). Выражение в скобках в левой стороне ()
есть . Уравнение () принимает вид
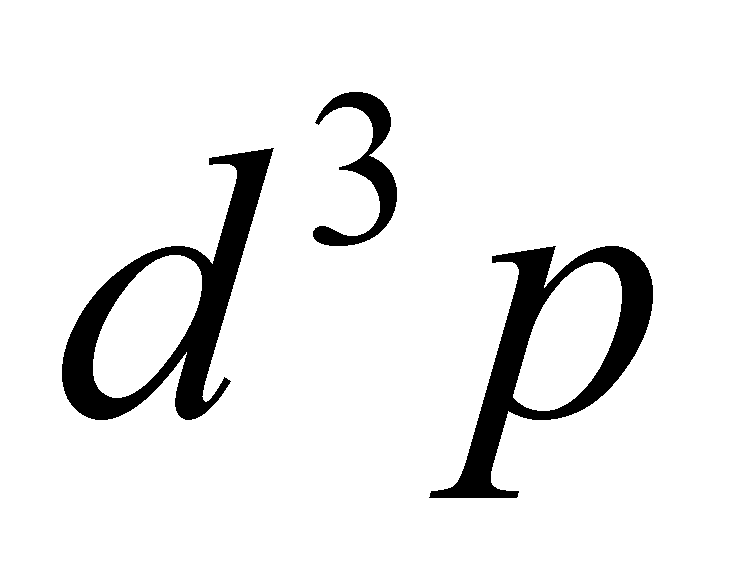
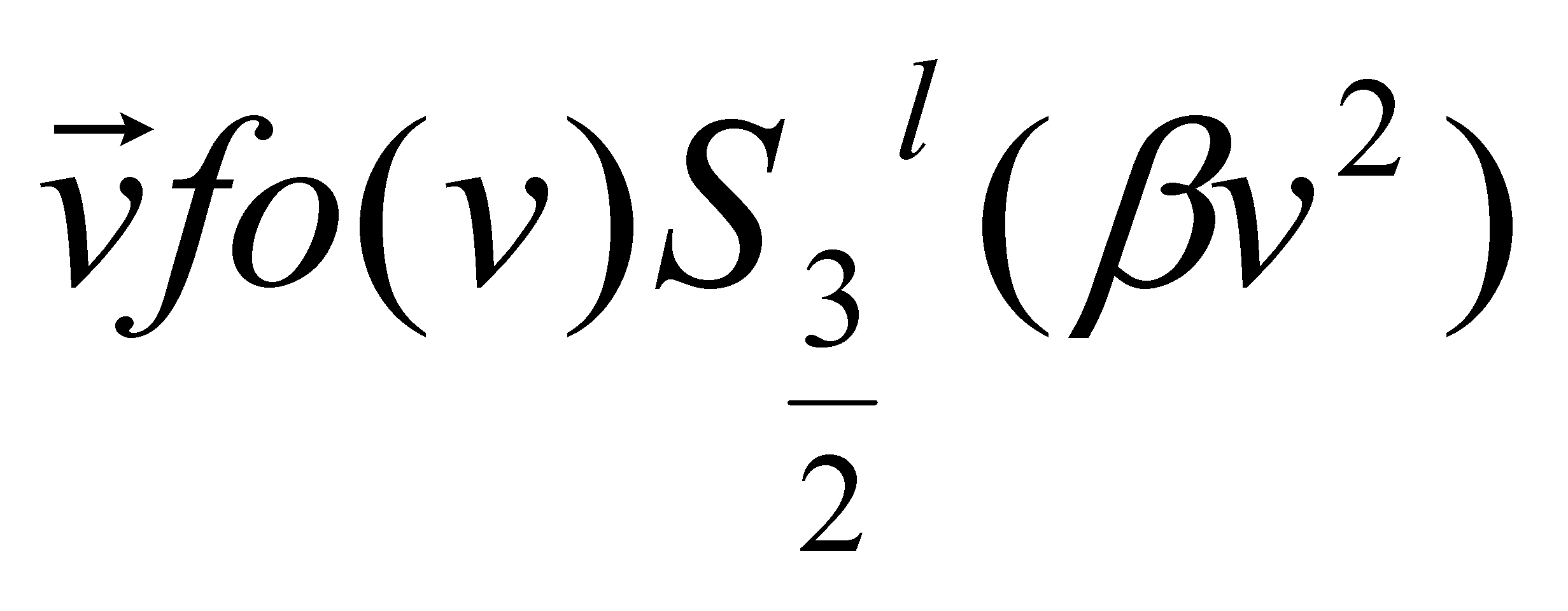
Умножим его с обеих сторон на и проинтегрируем по . Получим систему алгебраических уравнений, которая может быть решена на ЭВМ:
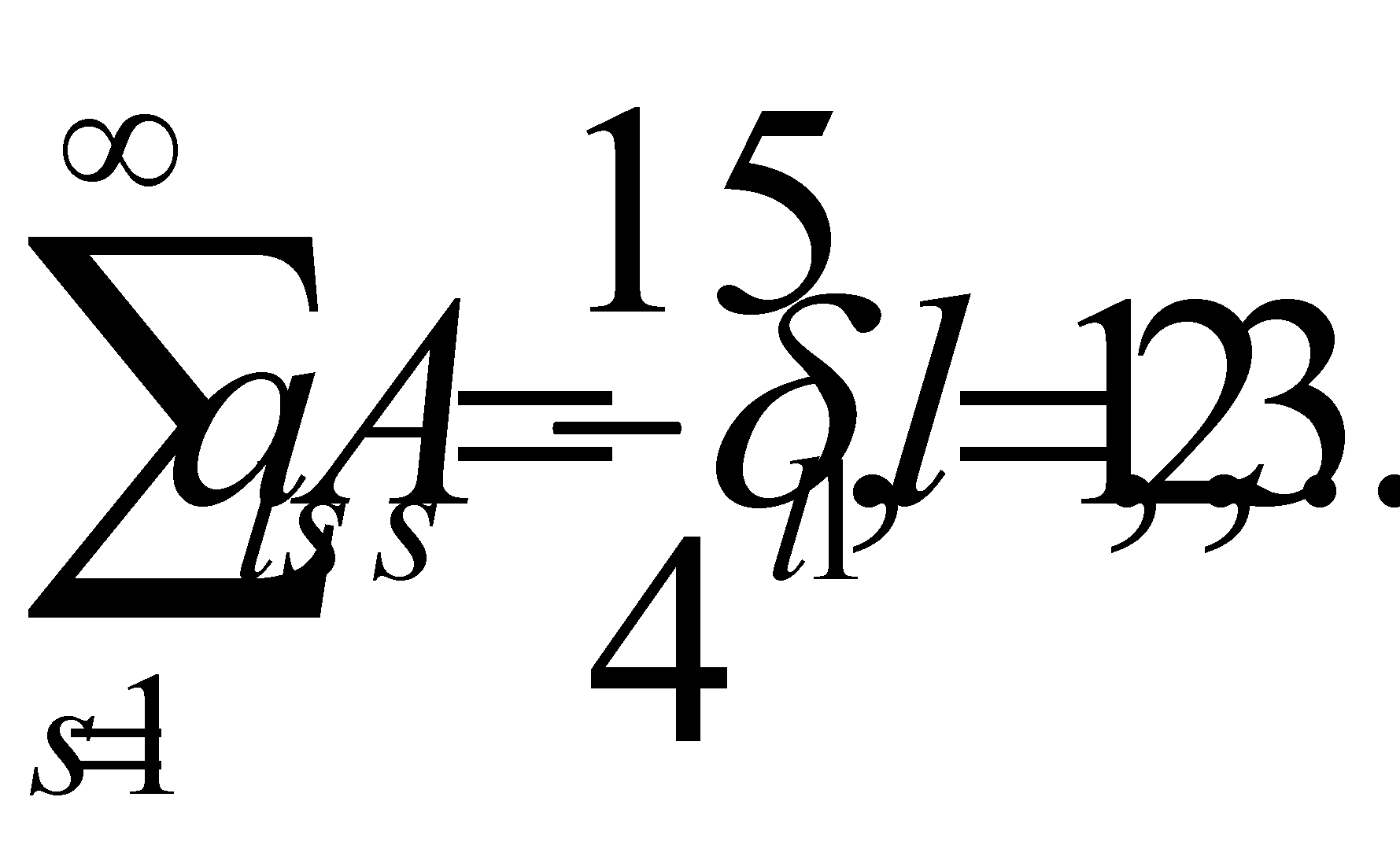
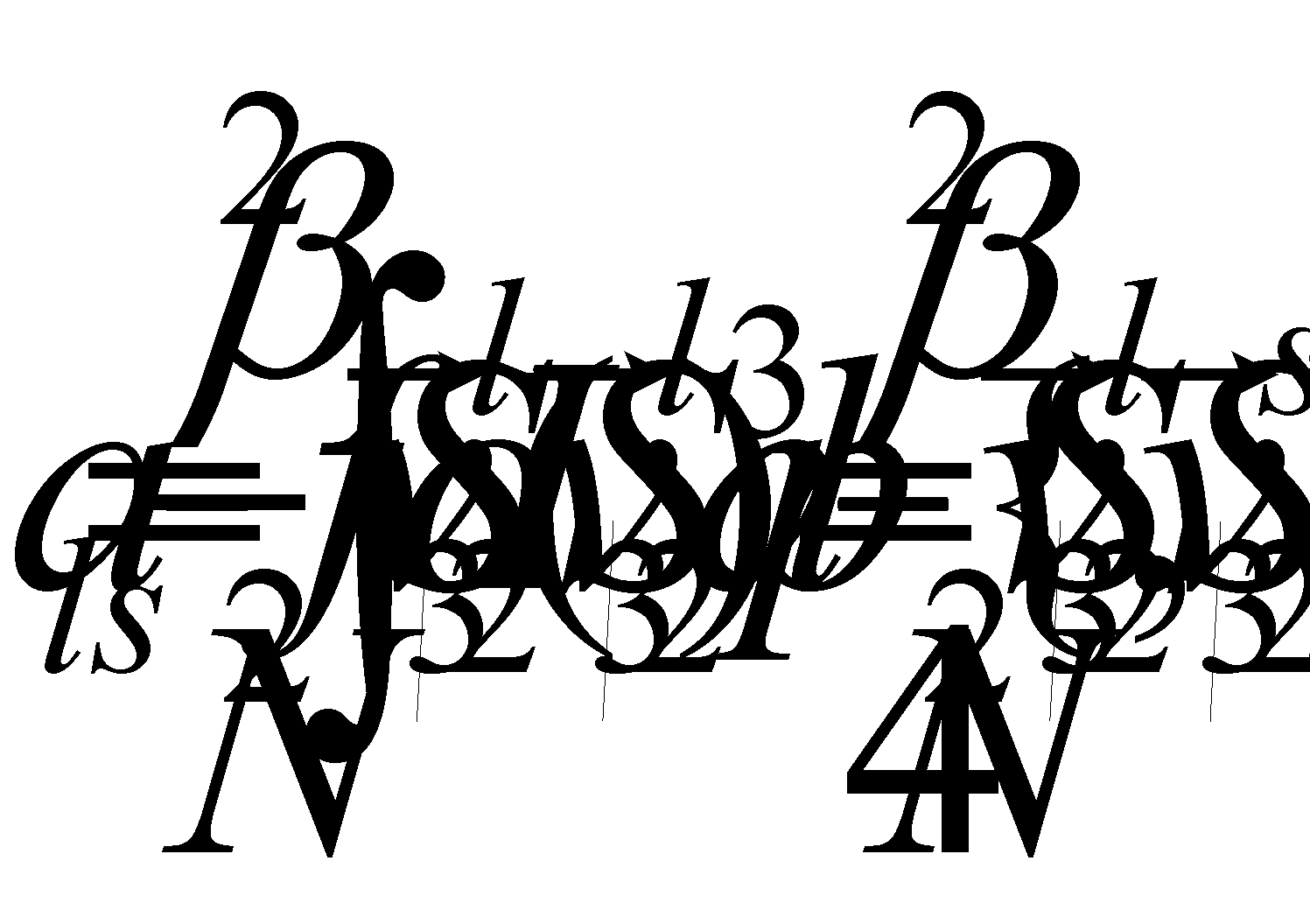
Причём
Для последнего выражения введены обозначения

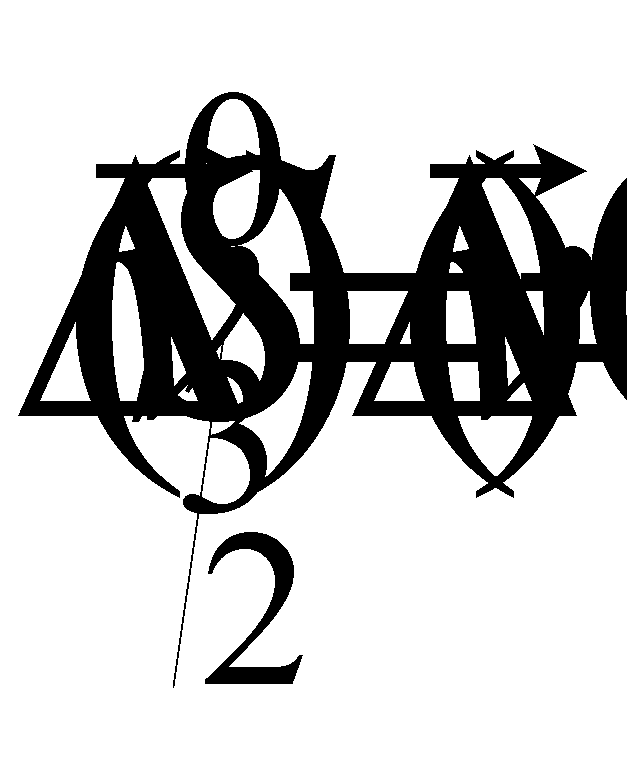
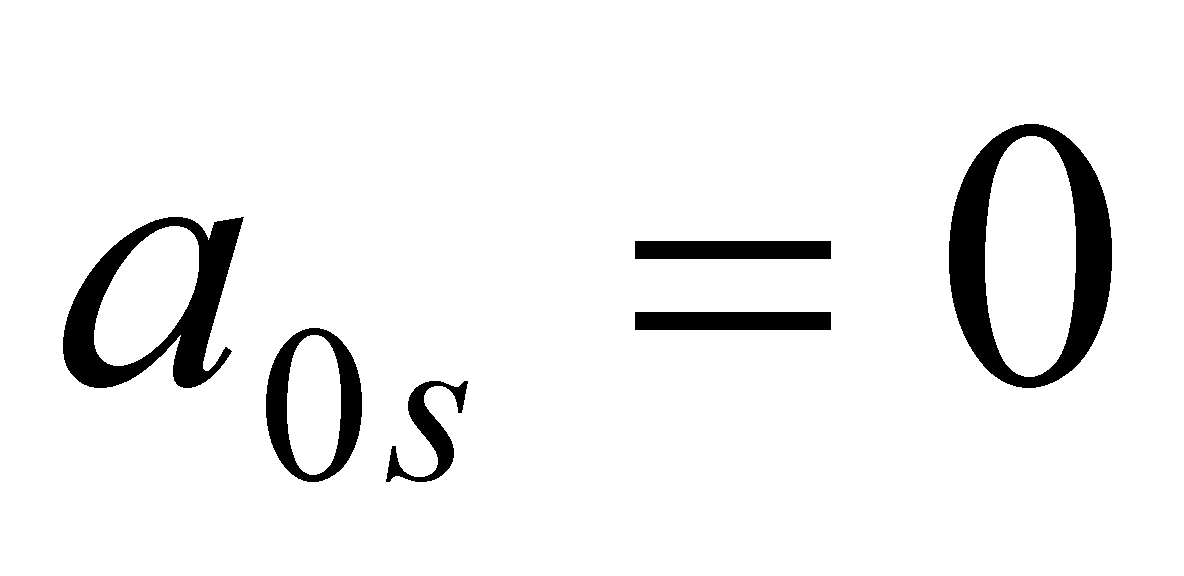
Уравнение с l=0 отсутствует, поскольку в силу сохранения импульса
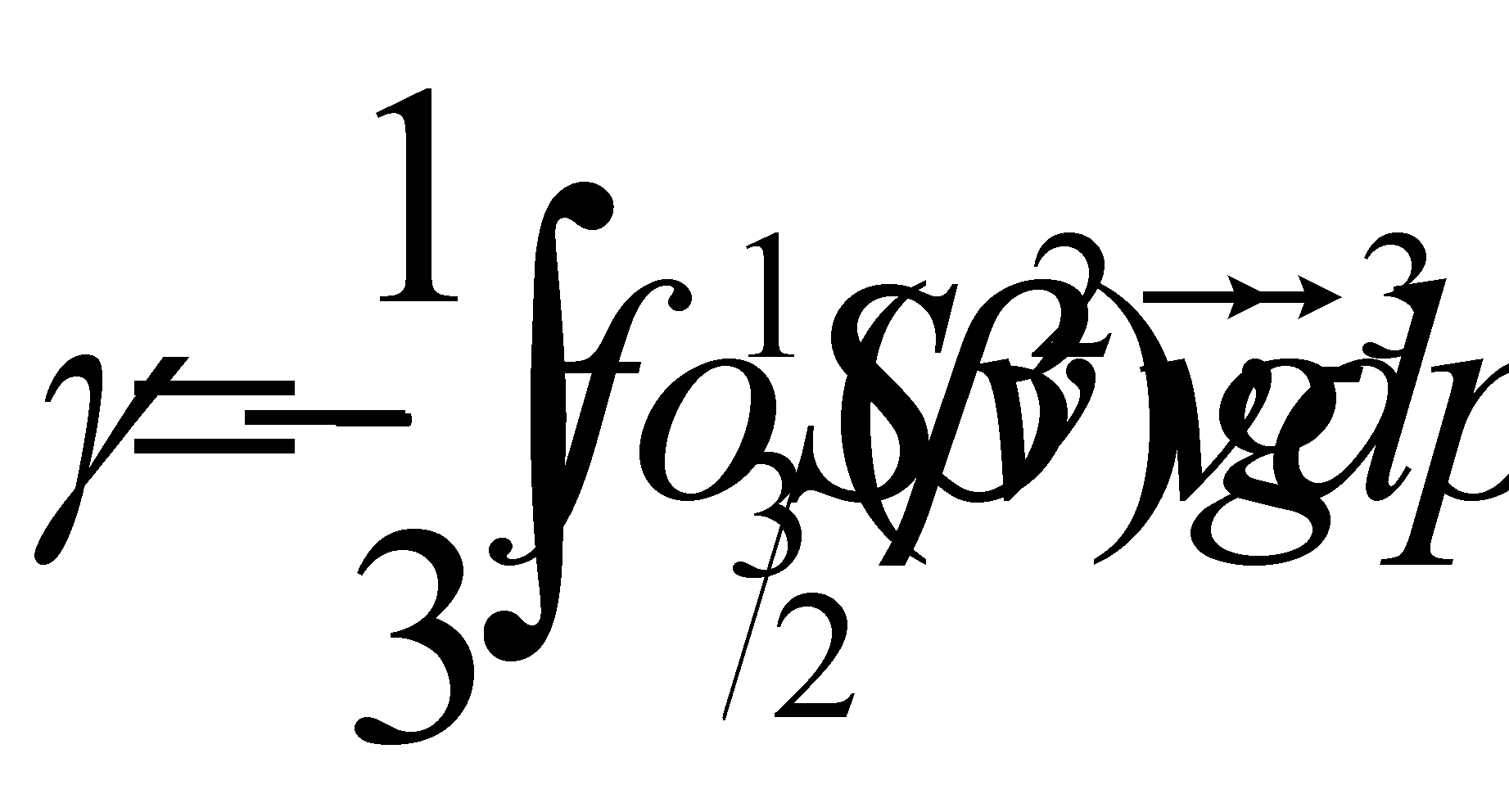
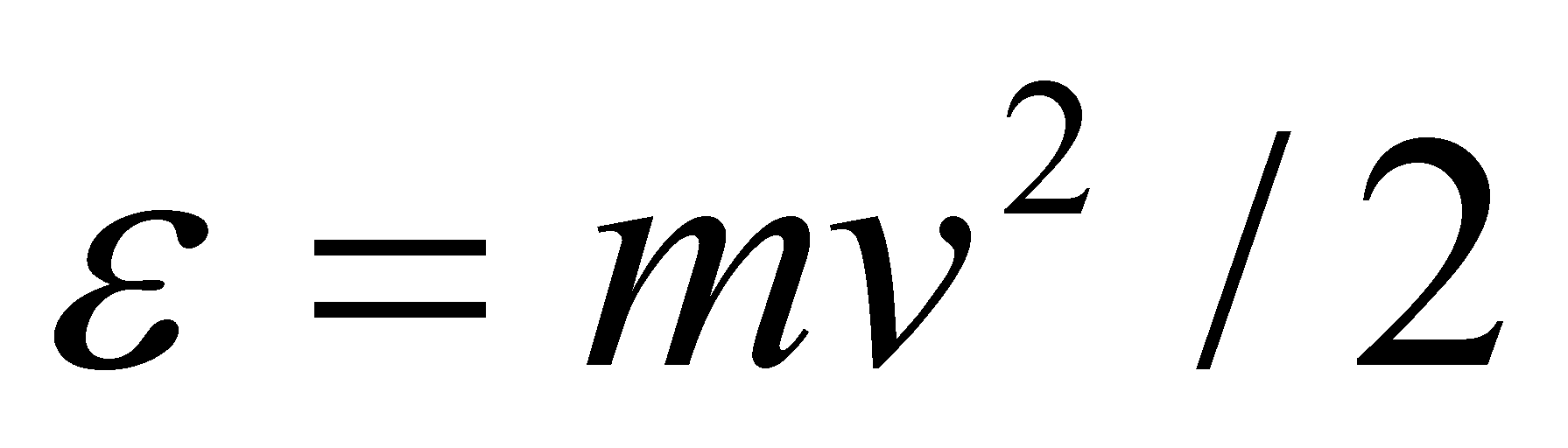
Коэффициент теплопроводности вычисляется подстановкой выражения () в интеграл (). С учётом условия () интеграл ( с ) может быть представлен в виде
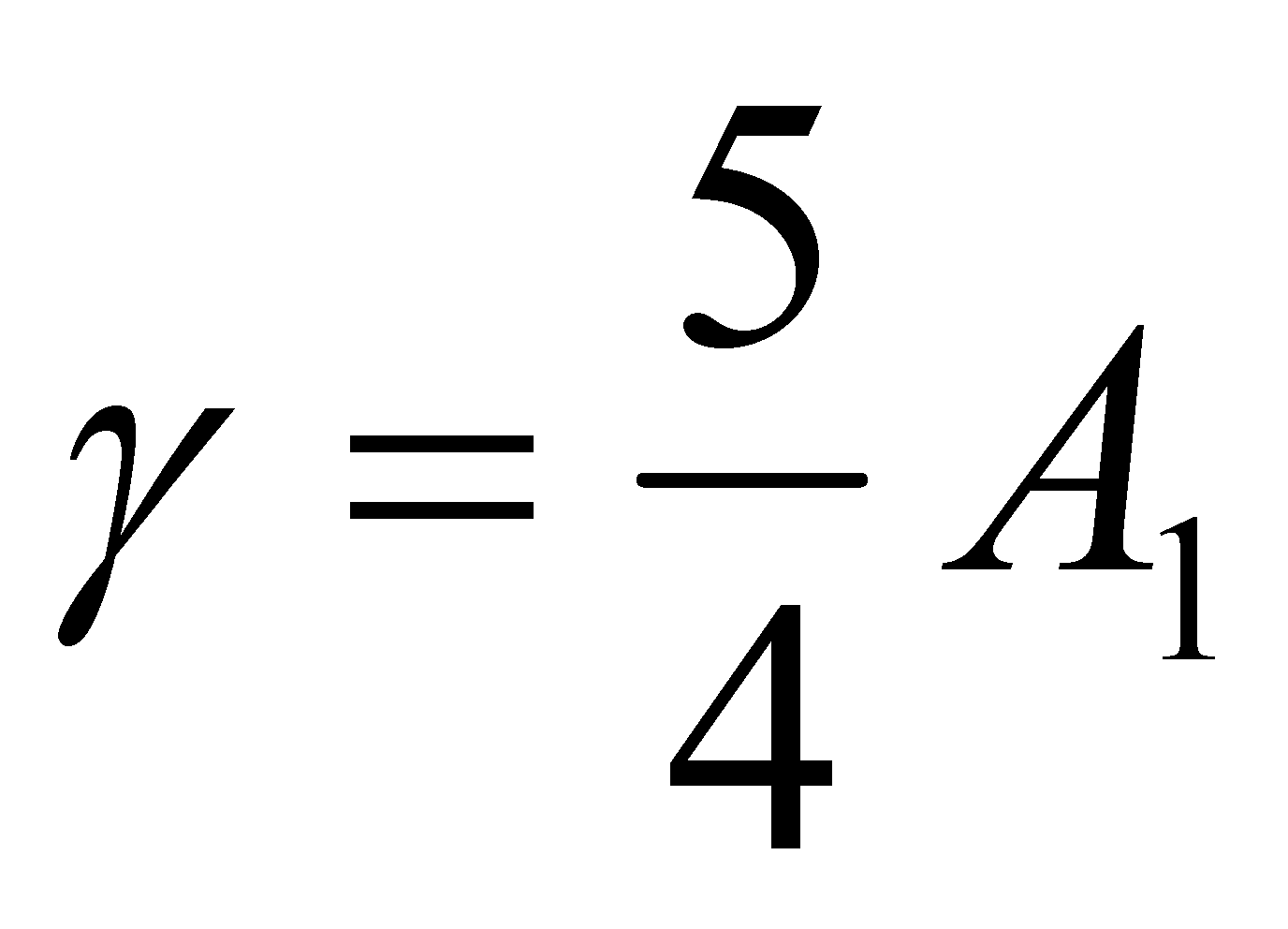
В результате находим .
Об эффективности численного метода с применением разложения по полиномам Сонона можно судить по простоте правой части () и окончательному выражению (). Полученная в ходе решения басконечная система линейных алгбраических уравнений решается после искусственного усечения.
Заключение.
Рассмотренный метод вывода кинетического уравнения Больцмана вполне удовлетворителен с физической точки зрения. Однако кинетическое уравнение может быть так же получено из математического аппарата, применяемого для описания движения частиц газа. В 1946 году такой вывод, получивший название динамического, бал дан Н. Н. Боголюбовым. Метод Боголюбова позволяет не только получить уравнение Больцмана, но и поправки к нему, т.е. члены следующих порядков по малому параметру газовости . Например, в указанном выводе учитывается одновременное столкновение только двух молекул и предполагается, что столкновения происходят в одной точке, т.е. являются локальными, и нет более или менее очевидного рецепта, позволяющего учесть столкновения групп из трёх, четырёх и большего числа частиц. Между тем ясно, что учёт подобных столкновений принципиально важен при рассмотрении плотных газов. В связи с этим целесообразно более строго подойти к выводу кинетического уравнения и к его возможным обобщениям. Метод Боголюбова позволяет учесть
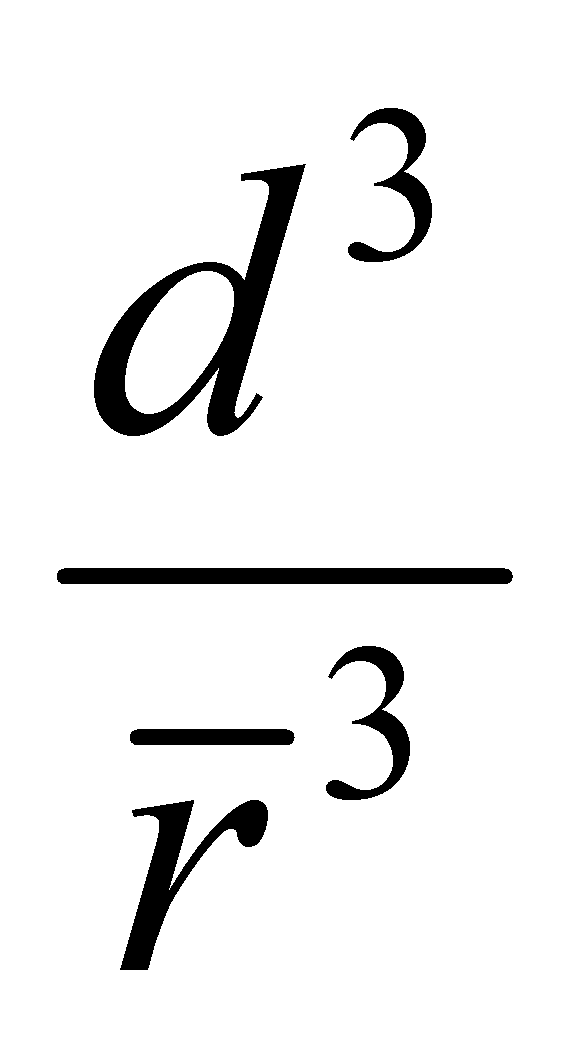
“нелокальность” столкновения и столкновения более, чем двух частиц при помощи определённых поправочных членов, возникающих при выводе. Пренебрежение поправками приводит кинетическое уравнение к виду, полученному в простейшем случае.
Ñïèñîê ëèòåðàòóðû.
1. Å.Ì.Ëèôøèö, Ë.Ï.Ïèòàåâñêèé. Ôèçè÷åñêàÿ êèíåòèêà. Íàóêà, Ì., 1979 ã.
2. Þ.Á.Ðóìåð, Ì.Ø.Ðûâêèí. Òåðìîäèíàìèêà, ñòàòèñòè÷åñêàÿ ôèçèêà è êèíåòèêà.
Íàóêà, Ì., 1972 ã.
Сайт управляется системой
uCoz![]()
![]()
![]()
![]() Для вывода кинетического уравнения Больцмана рассмотрим одноатомный идеальный газ, т.е. достаточно разряженный газ, состоящий из электрически нейтральных атомов или молекул. Единственным видом взаимодействия между частицами идеального газа являются столкновения между молекулами, происходящие, однако, настолько редко, что каждая молекула почти всё время движется как свободная
. Рассматривая частицы газа как классические, можно утверждать, что на одну частицу приходиться объём . Число частиц в единице объёма есть концентрация . Значит среднее расстояние между частицами есть ( предполагается достаточно большим по сравнению с радиусом действия межмолекулярных сил d). При получении уравнения Больцмана сделаем следующие предположения:
Для вывода кинетического уравнения Больцмана рассмотрим одноатомный идеальный газ, т.е. достаточно разряженный газ, состоящий из электрически нейтральных атомов или молекул. Единственным видом взаимодействия между частицами идеального газа являются столкновения между молекулами, происходящие, однако, настолько редко, что каждая молекула почти всё время движется как свободная
. Рассматривая частицы газа как классические, можно утверждать, что на одну частицу приходиться объём . Число частиц в единице объёма есть концентрация . Значит среднее расстояние между частицами есть ( предполагается достаточно большим по сравнению с радиусом действия межмолекулярных сил d). При получении уравнения Больцмана сделаем следующие предположения:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Вывод кинетического уравнения.
Вывод кинетического уравнения.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()